Lokal begrenztes Prostatakarzinom Abwarten, operieren oder bestrahlen
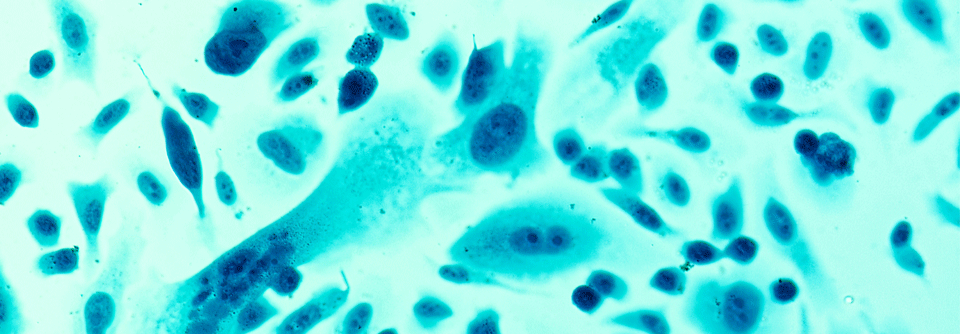
 Histologisch zeigen sich bei Gleason-Grad 4 kleine, unregelmäßige Drüsen und schlecht differenzierte Bereiche.
© wikimedia/Nephron
Histologisch zeigen sich bei Gleason-Grad 4 kleine, unregelmäßige Drüsen und schlecht differenzierte Bereiche.
© wikimedia/Nephron
Etwa 70.000 Männer erkrankten im Jahr 2022 in Deutschland neu an einem Prostatakarzinom (PCA). Mit einer Zehn-Jahres-Überlebensrate von 88 % haben sie gute Chancen, nicht an diesem Tumorleiden zu versterben.
Wichtigster Risikofaktor für das PCA ist das Alter, was auch bei der Therapieentscheidung eine Rolle spielt, schreiben Dr. Elisabeth Bartolf und Prof. Dr. Andreas Manseck von der Klinik für Urologie am Klinikum Ingolstadt. Außerdem relevant bei nicht-metastasiertem, lokal begrenztem Prostatakarzinom ist die Risikoklassifikation (siehe Kasten).
| Risikoklassifikation des Prostatakarzinoms nach d’Amico | |
|---|---|
| Risikogruppe | Parameter |
| niedriges Risiko | PSA-Wert < 10 ng/ml und |
| intermediäres Risiko | PSA-Wert 10–20 ng/ml oder |
| hohes Risiko | PSA-Wert > 20 ng/ml oder |
Active Surveillance
Nicht immer muss nach der Diagnose eines nicht-metastasierten Prostatakarzinoms sofort gehandelt werden. Um ein Zuviel an Therapie zu vermeiden, kommt unter bestimmten Bedingungen auch eine aktive Überwachung infrage. Anders als beim Watchful Waiting bleibt bei dieser Strategie die kurative Intention aber bestehen, d.h. man kontrolliert den Patienten engmaschig und leitet bei Progression sofort eine kurative Therapie ein.
Folgende Voraussetzungen müssen erfüllt sein:
- Niedrig-Risiko-Karzinom nach d’Amico
- maximal zwei befallene Stanzzylinder (bei Entnahme von zehn bis zwölf Stanzen)
- prozentualer Tumorbefall im Stanzzylinder ≤ 50 %
Zudem muss der Patient intensiv über das Vorgehen aufgeklärt und die Compliance gesichert werden.
In den ersten zwei Jahren sollte alle drei Monate eine PSA-Bestimmung und eine digitale Untersuchung durchgeführt werden. Bleibt die Erkrankung stabil, kann das Intervall danach auf sechs Monate ausgeweitet werden. Zudem sollte innerhalb des ersten Jahres eine weitere Stanzbiopsie folgen. War die erste bereits MRT-gestützt, kann man zwölf Monate warten, ansonsten wird schon nach sechs Monaten eine Gewebeentnahme mit MRT-Unterstützung empfohlen. Danach sollte über drei Jahre alle 12–18 Monate eine Biopsie erfolgen, später alle drei Jahre.
Watchful Waiting
Watchful Waiting ist eine rein palliative Strategie. Man wartet kontrolliert zu und greift erst ein, wenn Komplikationen drohen oder eingetreten sind. Mögliche Behandlungen können z.B. eine Hormonblockade, Interventionen zur Blutstillung, Bestrahlung bei Knochenschmerzen und die palliative transurethrale Resektionen von Prostataanteilen sein. Dieses Konzept eignet sich v.a. für Patienten in schlechtem Allgemeinzustand, mit schweren Komorbiditäten bzw. begrenzter Lebenserwartung.
Radikale Prostatektomie
Die radikale Prostatektomie (RPE) ist für alle Risikogruppen mit lokal begrenztem PCA als Primärtherapie geeignet. Ziel ist immer die kurative R0-Resektion – möglichst mit Erhalt von Harnkontinenz und Erektionsfähigkeit. Heute hat sich überwiegend ein roboterassistiertes minimalinvasives Verfahren durchgesetzt.
Man kann dem Patienten ein nervschonendes (erektionserhaltendes) Vorgehen anbieten – allerdings nur wenn die Ausdehnung des Tumors dies zulässt. Die onkologische Sicherheit, die eine R0-Resektion bietet, sollte jedoch immer Vorrang haben.
Strahlentherapie
Auch die perkutane Strahlentherapie (EBRT) ist eine primäre Therapieoption für alle Risikogruppen. Falls der Tumor bereits lokal fortgeschritten ist, sollte sie – im Gegensatz zur Prostatektomie – mit einer hormonablativen systemischen Therapie über 24–36 Monate kombiniert werden. Bei niedrigem und intermediärem Risiko entsprechen die onkologischen Ergebnisse der RPE.
Bei niedrigem Risiko kommt alternativ auch eine Low-Dose-Rate(LDR)-Brachytherapie mit dauerhafter Implantation von Palladium- oder Jod-Seeds infrage. Bei intermediärem oder hohem Risiko sollte sie mit EBRT und einem hochdosierten Boost plus Androgendeprivation kombiniert werden. Das Prostatavolumen muss dafür kleiner als 50 ml und der IPPS* < 12 sein, außerdem darf keine Restharnbildung vorliegen. Bei mittlerem und hohem Risiko kann auch zusätzlich zur EBRT eine dosiseskalierte HDR-Brachytherapie durchgeführt werden.
Fokale Therapien
Für gut selektionierte Patienten mit kleinem, wenig aggressivem Prostatakarzinom können bei dringendem Patientenwunsch auch fokale Therapien wie die hochintensive fokussierte Ultraschallablation (HIFU), die Kryotherapie oder die vaskuläre gezielte photodynamische Therapie (VTP) in Erwägung gezogen werden. Man verspricht sich davon ein besseres funktionelles Ergebnis. Gleichwertige onkologische Ergebnisse sind aber noch nicht mit Sicherheit belegt.
* International prostate symptom score
Quelle: Bartolf E, Manseck A. internistische praxis 2023; 66: 187-198