Idiopathische Lungenfibrose Ein Fall für die Präzisionsmedizin
 So personalisiert die Präzisionsmedizin auch ist – die Betreuung von IPF-Patienten durch ein multidisziplinäres Team wird sie nicht ersetzen.
© gio_tto – stock.adobe.com
So personalisiert die Präzisionsmedizin auch ist – die Betreuung von IPF-Patienten durch ein multidisziplinäres Team wird sie nicht ersetzen.
© gio_tto – stock.adobe.com
Ähnlich wie heute schon in der Onkologie werden genetische und molekulare Fingerabdrücke künftig die individuelle Prävention, Diagnostik, Therapie und Prognose insbesondere bei interstitieller Lungenfibrose (IPF) leiten. Da ist sich Prof. Dr. Athol Wells vom Royal Brompton Hospital in London sicher. Die Analogie zum Krebs reicht jedoch nicht weit: Dort haben Therapeuten es mit autonom wachsenden klonalen Zellen zu tun, bei denen es oft ausreicht, an einer einzigen Stelle zu intervenieren. Bei IPF hingegen „müssen wir uns um ein homöostatisches System kümmern mit einem ganzen Tsunami koaktivierter Pfade und einem Netzwerk molekularer Signale“, so Prof. Wells.
Vermeintlich kausale Aktivierungen können sich als Reaktionen des Organismus auf den eigentlichen Krankheitsprozess erweisen, die lediglich der Homöostase dienen. Der britische Kollege illustrierte das anhand des komplexen Zusammenspiels von Zellen und Mediatoren bei der Sarkoidose: Nahezu jede Zellart spielt bei dieser Erkrankung mit und jeder Signalweg, den das Immunsystem zu bieten hat. Daraus Informationen für eine Präzisionsmedizin oder gar einen primären Signalweg abzuleiten, an dem es sich lohnt anzusetzen, wird noch lange Zeit in Anspruch nehmen. Bei der IPF dürfte das Bild ähnlich aussehen.
Genomischer Klassifikator findet mehr Fälle als die HRCT
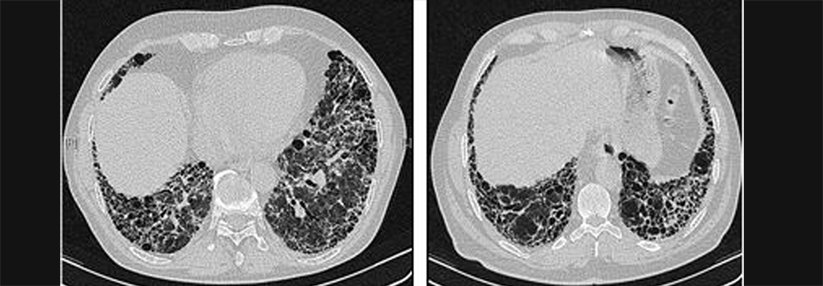
Das Feld, auf dem momentan die meisten präzisionsmedizinischen Fortschritte zu verzeichnen sind, ist die Diagnostik. So konnte ein genomischer Klassifikator unter 96 Patienten mit IPF-Verdacht 24 zusätzliche Fälle verifizieren, die der HRCT entgangen waren, aber in der transbronchialen Biopsie eine eindeutige UIP-Histologie zeigten.1 Für den molekularen Test wurde später in einer Metaanalyse ein positiver prädiktiver Wert von 92 % und ein negativer Vorhersagewert von 68 % errechnet. Um ein solches Instrument sinnvoll nutzen zu können, sollte man aber die individuelle Wahrscheinlichkeit für eine IPF beachten, die sich aus Anamnese und anderen Befunden ergibt, betonte Prof. Wells. Außerdem machen derartige Tests die multidisziplinäre Evaluierung nicht überflüssig, sondern erhöhen die diagnostische Zuverlässigkeit in Fällen, bei denen die übrigen Befunde ein unklares Bild ergeben haben.
In der Therapie lassen präzisionsmedizinische Ansätze auf sich warten. Das liegt nicht zuletzt daran, dass es noch gar keine Wirkstoffe gibt, die dafür geeignet wären. „Was wir aktuell haben, sind hochgradig pleiotrope dirty drugs“, konstatierte Prof. Wells. Er sieht aber Silberstreife am Horizont. Einer bezieht sich auf N-Acetylcystein (NAC), das als Partner einer immunsuppressiv-antioxidativen Tripletherapie in der PANTHER-Studie „spektakulär wirkungslos“ abgeschnitten hatte.2 Als die Ergebnisse aber nachanalysiert wurden, zeigte sich ein Überlebensvorteil bei einer Subgruppe von Patienten mit TT-Polymorphismus im Gen für das toll-interacting protein (TOLLIP), der auch in einer Replikationskohorte nachgewiesen werden konnte. NAC könnte die erste Präzisionstherapie für IPF werden. Allerdings muss der Nutzen bei Trägern des TT-SNP (single nucleotide polymorphism) noch in einer größeren prospektiven Studie bestätigt werden. Diese Studie läuft gerade in den USA.
Silberstreif Nr. 2 sieht Prof. Wells in einem PDE4B-Inhibitor namens BI 1015550, der in einer Phase-2-Studie erfolgreich den Abfall der Lungenfunktion verhindert hat.3 Der FVC-Unterschied gegenüber Placebo fiel mit rund 100 ml ohne und 80 ml mit antifibrotischer Backgroundtherapie geradezu dramatisch aus. Er erinnerte aber an Pamrevlumab, einen Antikörper gegen connective tissue growth factor (CTGF). Die 2020 veröffentlichte Phase-2-Studie zeigte noch eine Stabilisierung von FVC und HRCT, doch die größere Phase-3-Studie verlief enttäuschend. „Wie gut auch immer eine einzelne Studie aussieht – halten Sie die Luft an, bis Sie die zweite gesehen haben“, mahnte der Londoner Pneumologe. Die Zukunft könnte darin liegen, eine der „dirty drugs“ als Basis zu nutzen, um darauf neue spezifische Medikamente aufzusetzen.
Quellen:
1. Richeldi L et al. Am J Respir Crit Care Med 2021; 203: 211-220; DOI: 10.1164/rccm.202003-0877OC
2. Idiopathic Pulmonary Fibrosis Clinical Research Network. N Engl J Med 2012; 366: 1968-1977; DOI: 10.1056/NEJMoa1113354
3. Richeldi L et al. N Engl J Med 2022; 386: 2178-2187; DOI: 10.1056/NEJMoa2201737
ERS* Congress 2023
* European Respiratory Society