Hypertrophe obstruktive Kardiomyopathie lässt sich oft interventionell behandeln
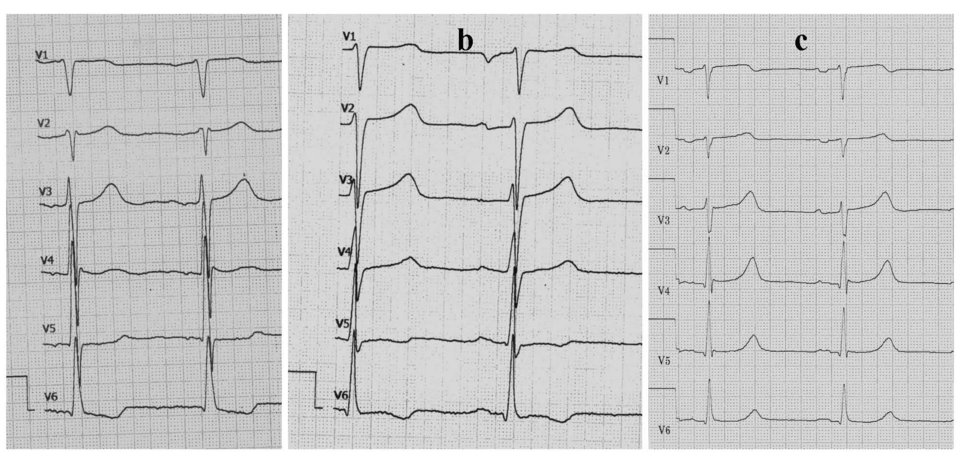
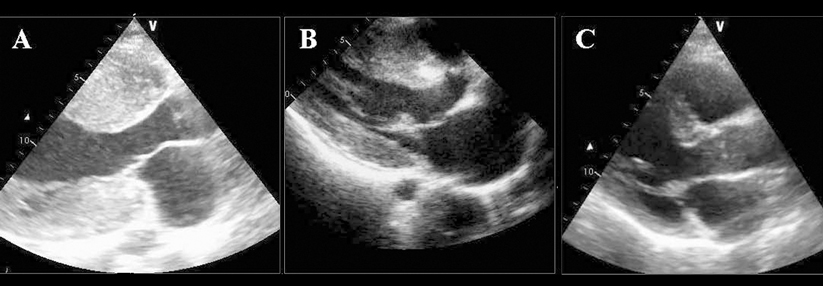 Die Echokardiographie von drei Geschwistern mit HOCM zeigt die deutliche Variabilität der Hypertrophie in Diastole.
© Quelle Text und Abb.: Koljaja-Batzner et al. internistische praxis 2018; 59: 187-201, © Mediengruppe Oberfranken - Fachverlage GmbH & Co. KG, Kulmbach
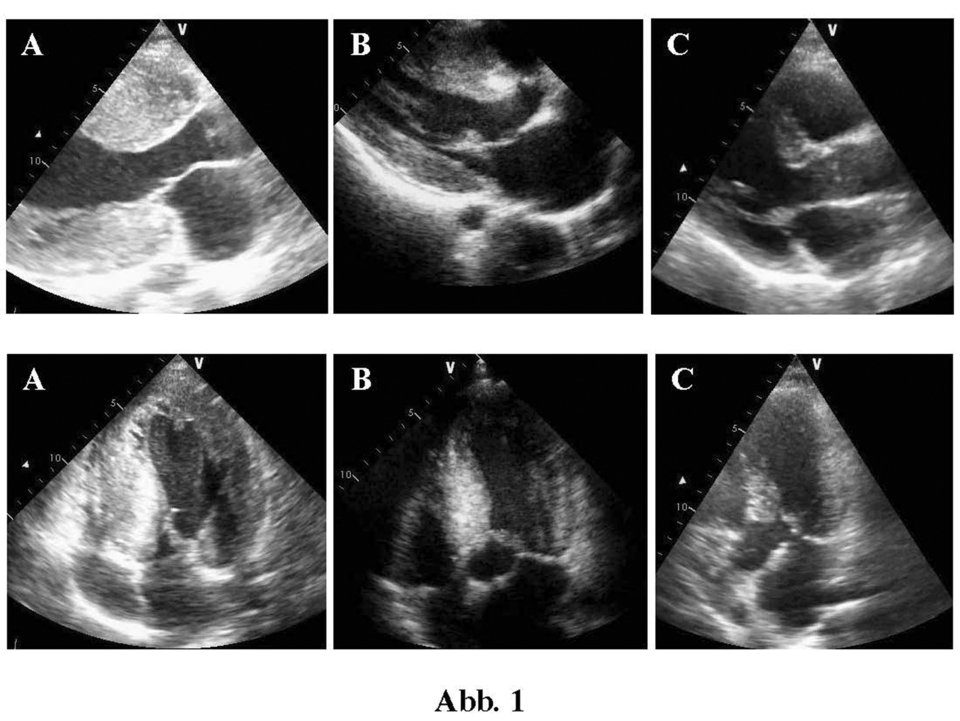
Die Echokardiographie von drei Geschwistern mit HOCM zeigt die deutliche Variabilität der Hypertrophie in Diastole.
© Quelle Text und Abb.: Koljaja-Batzner et al. internistische praxis 2018; 59: 187-201, © Mediengruppe Oberfranken - Fachverlage GmbH & Co. KG, Kulmbach
Zwar ist die hypertrophe Kardiomyopathie (HCM) die häufigste genetisch bedingte Herzkrankheit, sie bleibt mit einer Prävalenz von 0,2 % aber eine Seltenheit. Das gilt als wesentlicher Grund dafür, dass sie schwer und spät erkannt wird, schreiben Dr. Angelika Koljaja-Batzner von der Medizinischen Klinik am Klinikum Würzburg Mitte, Juliusspital, und Kollegen. 41 % der Betroffenen müssen mehr als drei Jahre auf ihre Diagnose warten.
Bei 40–60 % der Patienten findet sich eine autosomal dominant vererbte Mutation in einem Gen, das für ein kardiales Sarkomerprotein kodiert. In etwa 10 % der Fälle lassen sich andere Ursachen ermitteln, beim Rest bleiben die genauen Auslöser unbekannt. Eine Genanalyse flächendeckend einzuführen, erscheint daher für die Autoren nicht sinnvoll.
Die Engstelle ist meist dynamisch
Histologisch fällt bei der HCM eine Fehlanordnung der Myozyten auf – nicht nur in hypertrophierten Arealen – sowie eine unterschiedlich ausgeprägte Fibrose und Veränderungen der intramuralen Koronararteriolen. Unterschieden wird zwischen der obstruktiven Form (HOCM), die bei 70 % der Kranken vorliegt, und der nicht-obstruktiven Variante.
In der Regel ist die Obstruktion bei der HCM subaortal und – im Gegensatz zur fixen subaortalen membranösen Aortenstenose – dynamisch (u.a. abhängig von Vor- und Nachlast). Diastolische Dysfunktion und Myokardischämie mit variierender Symptomlast kennzeichnen die Erkrankung klinisch. Dyspnoe, Schwäche und Schwindel werden am häufigsten als Primärsymptome genannt, aber auch nur von rund 40 % der Patienten. Klassische Symptome wie Angina pectoris und Synkopen kommen eher selten vor. Auch deshalb wird die Erkrankung in der Praxis oft verzögert erkannt.
ACE-Hemmer können die Beschwerden provozieren
Oft haben die Betroffenen ihren Alltag bereits an die Einschränkungen angepasst, meiden z.B. Belastungen von sich aus. Die Symptomlast erscheint dadurch subjektiv geringer. Wichtig: Vasodilatatoren wie ACE-Hemmer oder Flüssigkeitsdefizite können klinische Beschwerden provozieren bzw. verschlechtern. Bedroht sind Patienten mit HCM vor allem durch den plötzlichen Herztod.
Die Auskultation weist auch heute noch den diagnostischen Weg: Nahezu pathognomonisch ist ein systolisches Austreibungsgeräusch mit einem Maximum über dem 4. Interkostalraum links parasternal, das bei einem Valsalva-Manöver lauter wird. Das Ruhe-EKG zeigt nicht zwingend typische Hypertrophiezeichen. Immer muss ein 48-Stunden-Langzeit-EKG durchgeführt werden, um tachykarde und bradykarde Arrhythmien zu erfassen. Dies stellt einen der Bausteine dar, um das Herztodrisiko einzuschätzen (s. Kasten).
Bedrohung durch plötzlichen Herztod
- Alter
- maximale linksventrikuläre Wanddicke (mm)
- Durchmesser des linken Vorhofs (mm)
- linksventrikulärer (Ausflusstrakt)-Gradient
- plötzlicher Herztod in der Familie: ja/nein
- nicht anhaltende ventrikuläre Tachykardie: ja/nein
- Synkope: ja/nein
Umstellung der Medikamente kann Druckgradienten senken
Eine primärprophylaktische ICD-Implantation empfehlen europäische Kardiologen, wenn aus verschiedenen Faktoren ein Risiko für den plötzlichen Herztod von mehr als 6 % in fünf Jahren besteht. Ziel der symptomatischen Therapie ist es, den linksventrikulären Ausflusstrakt-Gradienten zu senken, wenn er mehr als 50 mmHg beträgt. Doch Achtung: Er kann auch akzidentell durch eine antihypertensive Medikation, insbesondere mit ACE-Hemmern, AT1-Blockern oder Kalziumantagonisten, erhöht sein. Dann genügt es oft, die Medikation umzustellen. Ansonsten gibt es medikamentös nur wenige Optionen, im Einzelfall lässt sich der Gradient durch Betablocker senken. Gelingt das nicht, muss der Ausflusstrakt durch Myotomie/Myektomie oder perkutane Septumablation erweitert werden. Für eine interventionelle Septumablation eignen sich in erster Linie subaortale Ausflussbahnobstruktionen und mittventrikuläre Obstruktionen. Liegt eine Aortenstenose vor, muss operiert werden. Für die Intervention bevorzugt man heute die chemische Ablation mit absolutem Alkohol, die einen lokalisierten Infarkt auslöst. Die Folgen: Die Septumdicke nimmt ab, der Ausflusstrakt erweitert sich, der Gradient sinkt. Die Durchführung unter Echokontraststeuerung hilft dabei, Infarzierungen unerwünschter Areale zu vermeiden. Die Methode erzielt bei 90–95 % der Patienten gute Ergebnisse. Allerdings sind aus anatomischen Gründen oft Re-Interventionen notwendig. Bei bis zu 50 % der Patienten kommt es während der Behandlung zu einem AV-Block III. Grades, weshalb sich grundsätzlich ein passagerer Schrittmacher empfiehlt.Quelle Text und Abb.: Koljaja-Batzner et al. internistische praxis 2018; 59: 187-201, © Mediengruppe Oberfranken - Fachverlage GmbH & Co. KG, Kulmbach