Bei COPD präventiv denken – Dyspnoe verbessern – Exazerbationen und Mortalität reduzieren
 © iStock/magicmine
© iStock/magicmine
1. Einleitung
Die chronisch obstruktive Lungenerkrankung (COPD; chronic obstructive pulmonary disease) ist laut Definition der WHO1 eine progressive lebensbedrohliche Lungenerkrankung, die mit Dyspnoe, hohem Exazerbationsrisiko und schwerem Krankheitsverlauf einhergehen kann – und ist mit einer erhöhten Sterblichkeit verbunden. Aktuell belegt die COPD den dritten Platz auf der Liste der häufigsten Todesursachen.2 Entsprechend hoch ist die Zahl der Betroffenen. Weltweit waren 2016 laut dem Bericht der Global Burden of Disease Study 251 Millionen Menschen an COPD erkrankt. Für Deutschland war die Prävalenz nach der BOLD-Studie auf 5 bis über 10 % bei den über 40-Jährigen geschätzt worden.3 Raucher erkranken deutlich häufiger als Nicht-Raucher. Frauen haben aufgeholt: Die Prävalenz einer COPD ist bei ihnen in entwickelten Ländern inzwischen ebenso hoch wie bei Männern.4
Die Behandlungsstrategie bei COPD hatte lange Zeit vor allem die Bekämpfung der Symptome und die Verbesserung der Lebensqualität im Blick. Inzwischen mehren sich die Stimmen, die, ähnlich den Kardiologen, auf einen präventiven Therapieansatz setzen mit dem Ziel, die COPD per se und ihre Komplikationen zu reduzieren. Als primärpräventive Maßnahme zur Verhinderung der COPD schon im Vorfeld steht die Einschränkung des Tabakkonsums beziehungsweise dessen Verzicht an erster Stelle. Hat sich die COPD bereits manifestiert, gilt es durch eine effektive Sekundärprävention das Exazerbationsrisiko konsequent zu senken, und damit auch die Mortalität. Dies gelingt durch den gezielten Einsatz moderner Medikamente im Zusammenspiel mit nicht-pharmakologischen Maßnahmen.
2. COPD und Mortalität
Die COPD sollte in ihrer Bedrohlichkeit nicht unterschätzt werden. Sie kann in verschiedenen Schweregraden auftreten und ist mit Blick auf Morbidität und Mortalität eine der führenden Erkrankungen. Schweregrad und Prognose der chronisch obstruktiven Lungenerkrankung werden vor allem durch Exazerbationen und Komorbiditäten bestimmt.5 Eine Senkung der Sterblichkeit gelingt daher, wenn Exazerbationen bestmöglich reduziert und Komorbiditäten optimal behandelt werden. Definiert sind Exazerbationen laut S2k-Leitlinie „Diagnostik, Prävention und Therapie der chronisch obstruktiven Lungenerkrankung (COPD)“ als akute, über mindestens zwei Tage anhaltende Verschlechterungen der respiratorischen Symptome mit der Notwendigkeit einer Intensivierung der Therapie.5 Typisch in der akuten Situation ist die entzündlich bedingte vermehrte Bronchokonstriktion und/oder Schleimproduktion mit Überblähung. Der Patient leidet unter einer Zunahme von Atemnot, Husten, Sputumvolumen und Sputumpurulenz. Wichtig ist es, den Patienten gezielt danach zu fragen. Andernfalls werden Exazerbationen übersehen und entsprechend falsch therapiert.
2.1. Zusammenhang zwischen Exazerbationen und Mortalität
Schwere Exazerbationen gehen mit einer erhöhten Mortalität einher, wie verschiedene Studien zeigen. In einer prospektiven Kohortenstudie, in der man 304 Männer mit COPD (mittleres Alter: 71 Jahre) über fünf Jahre beobachtete, konnten akute COPD-Exazerbationen als unabhängiger Indikator für eine schlechte Prognose identifiziert werden. Das höchste Mortalitätsrisiko, nach einem höheren Alter, hatten Patienten mit drei und mehr Exazerbationen in der Anamnese (HR 4,13).6 Eine aktuellere Studie bestätigt die Abhängigkeit des Mortalitätsrisikos von der Exazerbationsrate. Schon eine moderate akute Exazerbation der COPD (AECOPD) erhöht die Mortalität gegenüber keiner AECOPD (Abb. 1).7
2.2. Kardiovaskuläre Erkrankungen als Komorbidität
Entscheidend für das Mortalitätsrisiko sind auch begleitende kardiovaskuläre Erkrankungen. Insbesondere in den leichteren Stadien der COPD sind sie eine der führenden Todesursachen. So ist das Risiko zu versterben bei Patienten mit moderater Atemwegsobstruktion und kardiovaskulären Erkrankungen höher als das Risiko von Patienten mit schwerer COPD ohne kardiovaskuläre Erkrankungen.5 Ergebnisse der SUMMIT-Studie,10 einer Mortalitätsstudie mit über 16 000 Patienten, die neben der COPD einen kardiovaskulären Risikofaktor oder ein kardiovaskuläres Ereignis in der Anamnese aufwiesen, zeigen einen klaren Zusammenhang zwischen Exazerbation und kardiovaskulären Ereignissen im Vorfeld. Kardiovaskuläre Erkrankungen, darunter koronare Herzerkrankung mit und ohne stattgehabten Myokardinfarkt, Herzrhythmusstörungen, Herzinsuffizienz oder auch eine peripher-arterielle Verschlusskrankheit, gehören zu den häufigen Komorbiditäten bei der COPD. Das Gesamtrisiko von COPD-Patienten für eine Herz-Kreislauf- Erkrankung ist um das 2,5-Fache erhöht.2.3. Therapieziel: Prävention von Exazerbationen
Exazerbationen sind angesichts der Datenlage unstrittiger Risikofaktor für die Mortalität bei COPD. Eine positive Exazerbationsanamnese gilt als Prädiktor für ein erhöhtes Exazerbationsrisiko, sprich Patienten, die bereits eine Exazerbation durchgemacht haben, laufen Gefahr für ein erneutes Ereignis. Hier eröffnen sich konkrete Chancen, in die Progression der COPD durch Reduktion der Exazerbationen präventiv einzugreifen. Denn bei weniger Exazerbationen sinkt auch die COPD-assoziierte Mortalität. Exazerbationen sollten deshalb ins Zentrum der diagnostischen und therapeutischen Bemühungen gestellt werden. Sie früh zu erkennen und adäquat zu behandeln, ist entscheidend für die Prognose des Patienten. Der erste Schritt ist, ähnlich wie in der Kardiologie, die Risikostratifizierung mit einer strukturierten Anamneseerhebung, in der die Zahl der Exazerbationen tatsächlich erhoben wird. Dabei ist es wichtig, dass der Patient weiß, was eine Exazerbation ist (siehe oben). Neben der Prüfung der Lungenfunktion, der Sauerstoffsättigung und gegebenenfalls der Blutgase sollten familiäre Vorbelastungen, Komorbiditäten und Vorerkrankungen sowie weitere Risikofaktoren, beispielsweise Rauchgewohnheiten, möglichst erfasst werden. In dieser Situation ist eine Differenzialdiagnose wichtig. Eine Exazerbation muss von einer dekompensierten Herzinsuffizienz, einem akuten Koronarsyndrom bzw. einer Lungenarterienembolie differenzialdiagnostisch abgegrenzt und eine Pneumonie oder ein Pneumothorax ausgeschlossen werden.3. Aktuelle Empfehlungen zur Diagnose und Therapie der COPD
Die neuen Erkenntnisse rund um die COPD sind inzwischen in die Empfehlungen von GOLD (Global Initiative for Chronic Obstructive Lung Disease) eingegangen, an denen sich auch die deutsche S2k-Leitlinie orientiert. Gefordert wird eine frühe (Differenzial-)Diagnose, gefolgt von einer personalisierten Medizin, die sich am Ausmaß der Dyspnoe und an der Häufigkeit und dem Schweregrad der auftretenden Exazerbationen orientiert. Dass dieses Konzept trägt, konnte inzwischen in verschiedenen Studien gezeigt werden.3.1. Schlüsselindikatoren für eine frühe Diagnosestellung
Es besteht kein Zweifel: Eine COPD sollte so früh wie möglich diagnostiziert und so wirksam wie möglich behandelt werden. Damit lassen sich die Symptome reduzieren, die Progression verlangsamen und lässt sich die Lebensqualität verbessern. GOLD empfiehlt eine COPD ins Kalkül zu ziehen, wenn bei über 40-Jährigen folgende Schlüsselindikatoren auftreten:- persistierende, progressiv verlaufende Dyspnoe, die sich unter Belastung verschlechtert
- chronischer Husten und chronische Sputumproduktion
- rezidivierende Infektionen der unteren Atemwege
- Risikofaktoren in der Anamnese, darunter Rauchen, Chemikalienkontakt, familiäre Disposition
3.2. GOLD-Klassifikation: von der spirometrischen Einteilung der Obstruktion zur individuellen Risikostratifizierung
Die COPD ist definiert durch eine irreversible Atemwegsobstruktion. Die Spirometrie, gemeinsam mit der Symptomatik und dem Vorliegen von Risikofaktoren, ebnen den Weg zur korrekten Diagnose. Der spirometrische Befund ist maßgeblich für die initiale lungenfunktionelle Klassiffikation der COPD in die vier GOLD-Schweregrade, entsprechend dem Ausmaß der Atemwegsobstruktion, die in den letzten Jahren unverändert geblieben ist:- GOLD 1: leichte COPD mit FEV1 ≥ 80 % des Sollvolumens
- GOLD 2 : moderate COPD mit 50 % ≤ FEV1 < 80 % des Sollvolumens
- GOLD 3: schwere COPD mit 30 % ≤ FEV1 < 50 % des Sollvolumens
- GOLD 4: sehr schwere COPD mit FEV1 < 30 % des Sollvolumens
3.3. Moderne Therapie der COPD
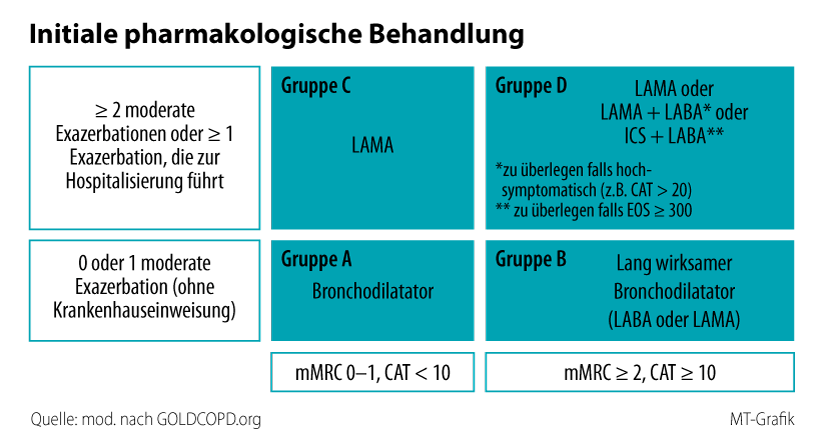
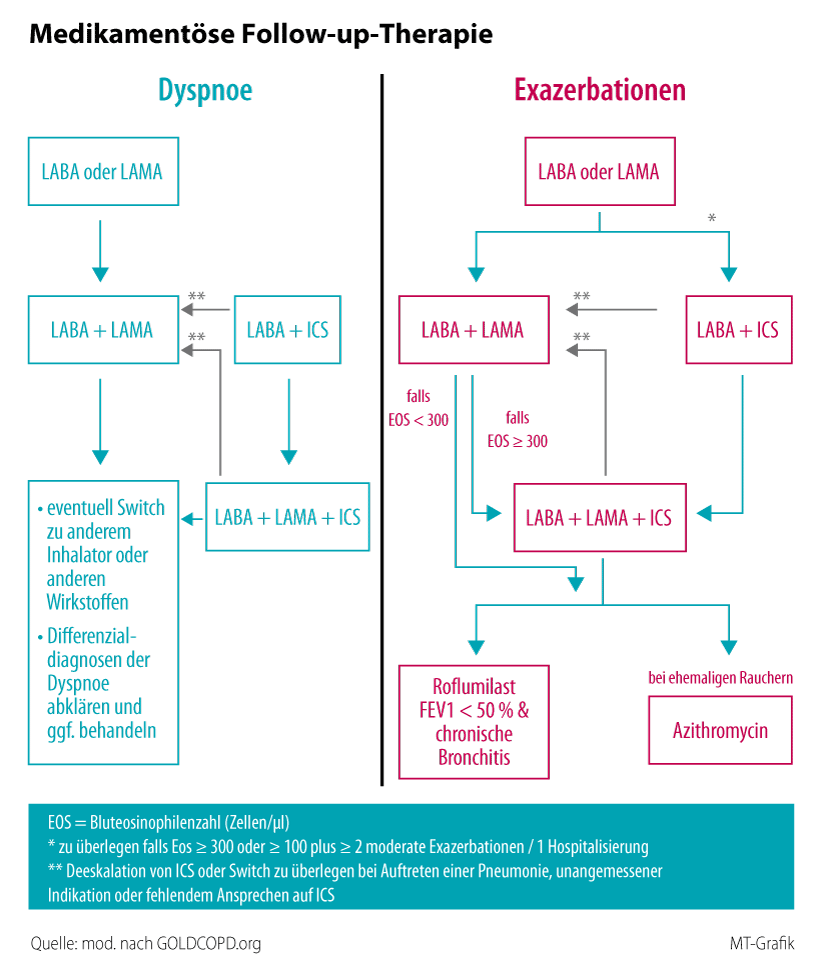
Der Präventionsgedanke ist auch in den aktuellen GOLD-Empfehlungen verankert. So werden als Therapieziele bei stabiler COPD nicht nur die Reduktion von Symptomen und eine bessere körperliche Fitness genannt, sondern auch die Prävention der Krankheitsprogression sowie die Reduktion von Exazerbation und Mortalität. Um diese Ziele zu erreichen, steht inzwischen eine ganze Palette von Wirkstoffen zur Verfügung, die ganz überwiegend inhalativ appliziert werden. Dazu gehören die kurz und lang wirksamen Beta-Agonisten SABA und LABA (SABA: Short-Acting Beta-Agonists; LABA: Long-Acting Beta-Agonists), lang wirksame Muskarinantagonisten (LAMA; Long-Acting Muscarinic-Antagonists) sowie inhalative Steroide (ICS). Die Wirkstoffe stehen für die Monotherapie, aber auch in Zwei- und/oder Dreifachkombinationen – LAMA/LABA, LABA/ICS, LAMA/LABA/ICS – zur Verfügung. Bei sehr schwerem Verlauf und entsprechender Indikation kommen zusätzlich Roflumilast oder auch Azithromycin als Langzeittherapie in Betracht. Im aktuellen Update schlägt GOLD die Unterscheidung zwischen einer pharmakologischen Initial- und einer Follow-up-Strategie vor. Denn die Therapie vorbehandelter Patienten macht ein anderes Prozedere erforderlich als eine Initialtherapie. Ist etwa ein Patient, der aufgrund seiner Symptomlast und der Exazerbationen des vorangegangenen Jahres initial der Hochrisikogruppe D zugeordnet werden musste, unter stadiengerechter Therapie das letzte Jahr infektfrei geblieben und hat weniger Beschwerden, so wird man ihn nicht in Gruppe C herabstufen und die Medikation reduzieren.11 Entscheidungskriterium für die initiale Therapie der COPD ist dabei nicht das Ergebnis der Spirometrie, sondern die Zuordnung des Patienten anhand der Vierfeldertafel (Abb. 2).3.4. Empfehlungen für den Einsatz von ICS
ICS einsetzen oder nicht? Zu dieser Fragestellung hat sich GOLD klar geäußert und Entscheidungskriterien für und gegen den Einsatz von ICS bei COPD formuliert und eine „Ampel“-Empfehlung entwickelt. Eindeutig für ICS sprechen:- mindestens zwei moderate COPD-Exazerbationen pro Jahr oder eine Hospitalisation wegen einer Exazerbation in der Anamnese
- Bluteosinophilenzahl > 300 Zellen/µl
- begleitendes Asthma oder eine frühere Asthmadiagnose
- einer moderaten COPD-Exazerbation pro Jahr
- einer Bluteosinophilenzahl zwischen 100 und 300 Zellen/µl
- rezidivierende Pneumonien, Bluteosinophile unter 100 Zellen/µl
4. Personalisierte Therapie der COPD: die Studienlage
Die Ziele der COPD-Therapie, wie sie von GOLD gefordert werden, lassen sich inzwischen mit den zur Verfügung stehenden Therapieregimes bei vielen Patienten erreichen. Das gilt auch für die Reduktion der Exazerbationen, mit der sich die Mortalität der COPD senken lässt. Die Ergebnisse aktueller klinischer Studien weisen dabei den Weg in eine personalisierte, hocheffektive Therapie.4.1. Duale Bronchodilatation bei Dyspnoe
Steht die Dyspnoe als Leitsymptom der COPD im Vordergrund, gilt es, die Symptomatik durch eine effektive Bronchodilatation zu reduzieren. Hier sollte bei symptomatischen Patienten mit niedrigem Exazerbationsrisiko frühzeitig eine duale Bronchodilatation überlegt werden. Den Vorteil gegenüber einer Monotherapie zeigte erst kürzlich die EMAX(Early MAXimisation of bronchodilation for improving COPD stability)-Studie, die erste große prospektive Studie, die eine LAMA/ LABA-Kombinationstherapie mit einer Monotherapie bei Patienten ohne ICS untersuchte.12 Unter der dualen Bronchodilatation mit einmal täglich Umeclidinium/Vilanterol über 24 Wochen wurde eine frühe und anhaltende Verbesserung der Lungenfunktion erreicht, die der Monotherapie mit Umeclidinium als auch der Monotherapie mit zweimal täglich Salmeterol überlegen war. Auch PROs (patient-related outcomes), wie der E-RS-Gesamtscore (Evaluating Respiratory Symptoms in Chronic Obstructive Pulmonary Disease), der Atemnot, Husten und Sputum sowie Brustbeschwerden erfasst, besserten sich deutlich gegenüber den jeweiligen Monotherapien. Der gefürchteten Abwärtsspirale bei COPD lässt sich so entgegenwirken.4.2. Prävention von Exazerbationen – Stellenwert von ICS
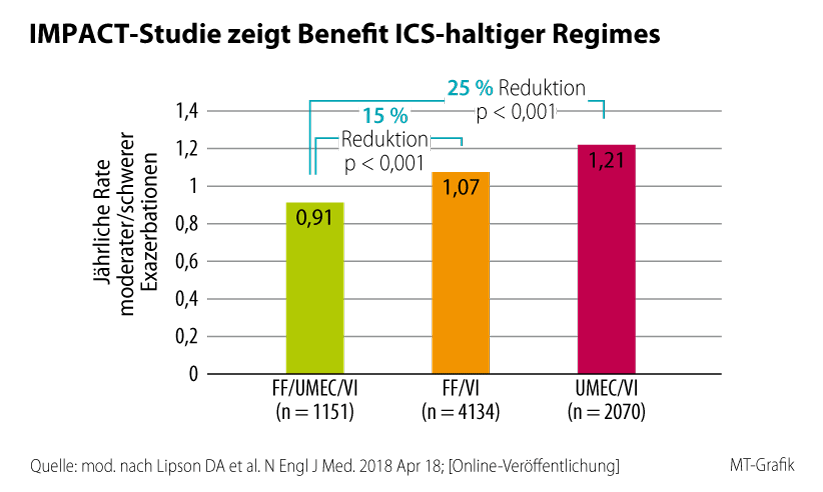
Auch bei einer positiven Exazerbationsanamnese startet die Therapie der COPD mit einer Bronchodilatation. Es stellt sich allerdings oft schon früh die Frage nach der Notwendigkeit einer LAMA/LABA/ICS-Tripletherapie (Verweis auf GOLD-Ampel), die die Häufigkeit von Exazerbationen reduzieren kann. Gezeigt wurde dies unter anderem für die Dreifachfixkombination aus Fluticasonfuroat/Umeclidinium/Vilanterol. In der Zulassungsstudie FULFIL (Lung FUnction and Quality of LiFe Assessment in COPD with Closed TrIpLe Therapy) senkte sie das Exazerbationsrisiko gegenüber einer ICS/LABA-Therapie um 35 %.13 Noch mehr klinisch relevante Informationen zur Bedeutung der Dreifachtherapie bei COPD lieferte IMPACT (InforMing the PAthway of COPD-Treatment), eine der bislang größten Phase-3-Studien zur COPD.14 Die dreiarmige Untersuchung verglich die Dreifachfixkombination FF/UMEC/VI mit den beiden dualen Fixkombinationen UMEC/VI und FF/VI über 52 Wochen. Eingeschlossen wurden 10 335 symptomatische Patienten mit moderater bis schwerer COPD, die in den letzten zwölf Monaten mindestens eine Exazerbation durchgemacht hatten. Der Blick auf den primären Endpunkt – die jährliche Rate moderater/schwerer Exazerbationen – zeigt den Vorteil der zusätzlichen ICS-Gabe. Waren alle drei Wirkstoffklassen mit an Bord – ICS/LAMA/LABA –, reduzierte sich die jährliche Rate moderater/schwerer Exazerbationen (koprimärer Endpunkt) hochsignifikant um 15 % gegenüber FF/VI und um 25 % gegenüber UMEC/VI (0,91 vs 1,07 vs. 1,21; p < 0,001). Auch schwere Exazerbationen mit Krankenhausaufenthalt waren signifikant seltener. Dabei profitierten schon Patienten mit nur einer moderaten/ schweren Exazerbation von einem ICS. Die Umstellung auf eine Dreifachkombination scheint demnach schon ab der ersten Exazerbation in Erwägung zu ziehen (Abb. 5).4.3. Reduktion der Gesamtmortalität
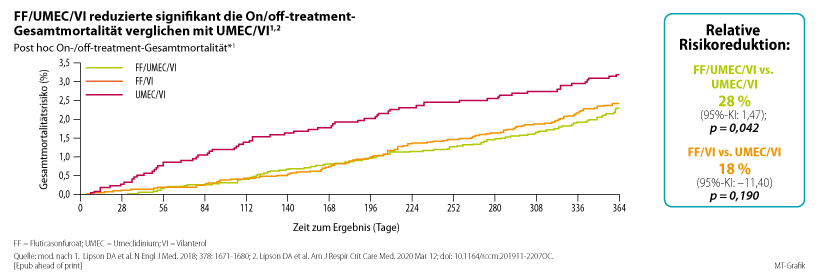
Was IMPACT besonders interessant macht: Sie zeigte erstmals, dass mit der Reduktion der Exazerbationen eine Reduktion der Gesamtmortalität einhergeht, so das Ergebnis einer sekundären Analyse (Abb. 6).14 Die Zahl der Todesfälle lag unter FF/UMEC/VI bei 98 (2,36 %), unter FF/VI bei 109 (2,64 %) und unter UMEC/VI bei 66 (3,1 %; HR für Tod: 0,72 vs. UMEC/VI und 0,89 vs. FF/VI).4.4. Subgruppenanalysen der IMPACT-Studie
Als Prädiktor für das Ansprechen auf ICS kann die Eosinophilenzahl im Blut (BEC) der COPD-Patienten herangezogen werden. Eine Analyse der IMPACT-Daten zeigte: Je höher die BEC zu Therapiebeginn, desto größer der Effekt ICS-haltiger Regimes im Vergleich zu UMEC/VI.17 Dass sich mit einer dualen Therapie nicht bei allen Patienten ein zufriedenstellendes Therapieergebnis erreichen lässt, eine Dreifachtherapie also durchaus notwendig sein kann, zeigt eine Post-hoc-Analyse von IMPACT.18 Sie analysierte Patienten, die während des zweiwöchigen Screenings vor Randomisierung mit einer offenen Dreifachkombination behandelt, dann aber auf eine UMEC/VI- oder FF/VI-Therapie umgestellt wurden. Der Step-down auf eine Zweifachtherapie hatte einen ungünstigen Effekt auf Exazerbation, Lungenfunktion und Lebensqualität.4.5. Nebenwirkung Pneumonie
ICS erhöhen generell das Risiko für eine Pneumonie – ein Klasseneffekt also. Das ist unumstritten. Auch in der ETHOS-Studie, die Budesonid in verschiedenen Dosierungen als ICS einsetzte, war das Pneumonierisiko vergleichbar dem der IMPACT-Studie mit FF als ICS.15 Darauf muss geachtet und gegebenenfalls rasch interveniert werden. Ein viel größeres Risiko für die Patienten sind allerdings moderate und schwere Exazerbationen, die mit einem erhöhten Mortalitätsrisiko einhergehen. Sie werden durch die Dreifachkombination signifikant reduziert, sodass der Nutzen die Gefahr einer Pneumonie bei Weitem überwiegt. Das Nutzen-Risiko-Verhältnis fällt klar zugunsten der Dreifachkombination aus.14,155. ICS: Unterschiede in Chemie und Pharmakologie
5.1 Bindungsaffinität zum Glukokortikoidrezeptor
Inhalative Kortikosteroide (ICS) haben sich in der Therapie der COPD in den letzten Jahren fest etabliert. Doch nicht jedes ICS ist wie das andere. Zwischen den einzelnen Kortikosteroiden gibt es eine ganze Reihe an Unterschieden, die Wirksamkeit und Nebenwirkungen bestimmen. Dazu gehört die Bindungsaffinität der einzelnen ICS an den Glukokortikoidrezeptor (GR). Die höchste GR-Bindungsaffinität unter den in Deutschland zugelassenen ICS hat Fluticasonfuroat (FF), gefolgt von Mometasonfuroat und Fluticasonpropionat. Je höher die GR-Affinität, umso länger ist die Lungenretentionszeit und um so niedriger die therapeutisch erforderliche Dosis. Dies kann das Potential für systemische Nebenwirkungen senken. Dabei reichen kleine chemische Unterschiede, um die GR-Bindungsaffinität zu beeinflussen. So unterscheiden sich Fluticasonpropionat (FP) und Fluticasonfuroat (FF) chemisch nur in einer Seitenkette. Diese Seitenkette macht das FF-Molekül aber passgenau für das Andocken an den Rezeptor. Die Verweildauer wird verlängert und es wird weniger Wirkstoff notwendig. Die Menge an FF, die in die systemische Zirkulation gelangt, bleibt daher selbst in maximal zugelassener Dosierung weit unterhalb der Schwelle, ab der die Hypophysen-Nebennieren-Achse gestört wird. Damit sinkt das Risiko systemischer Nebenwirkungen. FF ist daher ein hochpotentes ICS mit gleichzeitig guter Verträglichkeit.5.2. Entscheidungskriterium „therapeutischer Index“
Als Entscheidungshilfe zwischen den einzelnen ICS kann der therapeutische Index (TI) zur Bewertung des Nutzen-Risiko-Profils herangezogen werden. Definiert wird er als Verhältnis der antiinflammatorischen Wirkung in der Lunge zur unerwünschten körpereigenen Kortisolsuppression als Biomarker für die systemische Exposition.19 Eine randomisierte, zweiphasige Dosiseskalationsstudie, durchgeführt mit Asthmapatienten, konnte nun beim Vergleich von Fluticasonfuroat, Fluticasonpropionat und Budesonid zeigen, dass es zwischen den ICS nicht nur Unterschiede in der GR-Bindungsaffinität gibt, sondern auch im therapeutischen Index. FF war dabei FP und BUD signifikant überlegen (FF > FP: 18,6 vs. 1,84; FP > Bud: 1,84 vs. 1,31; Abb. 7). Danach kann FF in einer Dosis von 100 μg/d eine höhere antiinflammatorische Effektivität besitzen als die verglichenen Inhalationssteroide in den zugelassenen Höchstdosen von 1000 μg/d bei FP und 1600 μg/d bei BUD – bei gleichzeitig niedrigerer systemischer Aktivität.6. Nicht-pharmakologische Therapie der COPD5
6.1. Schadstoffexposition verhindern
Bei der COPD führt an einer medikamentösen Therapie kein Weg vorbei. Sie sollte aber begleitet werden von nicht-pharmakologischen Maßnahmen, die ebenfalls der Prävention dienen. Im Vordergrund steht die Raucherentwöhnung als wirksamste und kosteneffektivste Einzelmaßnahme, um eine COPD von vornherein zu verhindern beziehungsweise deren Progression zu verlangsamen.5 Mit einer Verhaltenstherapie in Kombination mit Pharmakotherapie lassen sich Abstinenzraten von 25 % und mehr erreichen. Als notwendige Schutzimpfungen bei COPD empfiehlt die Ständige Impfkommission die jährliche Impfung gegen Influenza sowie die Impfung gegen Pneumokokken als Indikationsimpfung.20,21 Ebenfalls als präventive Maßnahme gilt die Arbeitsplatzhygiene. Ziel ist es, berufstätige COPD-Patienten am Arbeitsplatz vor Schadstoffexposition zu schützen, einschließlich durch Passivrauchen.6.2. Kraft, Ausdauer, Beweglichkeit und Koordination
Das sind die Ziele, die durch regelmäßiges körperliches Training erreicht werden sollen – auch bei Patienten mit COPD.6.3. Adhärenz sicherstellen
Die Therapieadhärenz steht damit in engem Zusammenhang mit dem Therapieerfolg. Sie sollte ebenso wie die Inhalationstechnik im Krankheitsverlauf regelmäßig überprüft werden, denn Adhärenz ist Voraussetzung für den Therapieerfolg. Bei inhalativen Therpieregimes kann sie unterstützt werden durch tägliche Einmalgabe, eine einfach anzuwendende Inhalationstechnik, möglichst ohne Wechsel des Inhalators, und ein vertrauensvolles Verhältnis zum Patienten. Von Vorteil können inhalative Atemwegstherapeutika sein, die im gleichen Inhalator appliziert werden, wie z.B. dem Inhalator von GSK. Bei einer Therapieanpassung im Sinne einer Deeskalation oder Eskalation ändert sich deshalb die Inhalationstechnik nicht. Wie einfach die Anwendung ist, zeigen auch die Ergebnisse einer randomisierten offenen Cross-over-Studie: COPD-Patienten machten bei Anwendung dieses Inhalators* weniger kritische Anwendungsfehler als mit vergleichbaren Inhalatoren.22 Alle Patienten konnten den Inhalator* nach Unterweisung durch medizinisches Fachpersonal korrekt selbstständig applizieren.236.4. Prognose
Ebenfalls wichtig für die Prognose ist die Patientenschulung, und zwar bei allen Schweregraden der Erkrankung. Dadurch lässt sich das Management der Erkrankung wesentlich verbessern. Jeder Patient mit COPD sollte deshalb Zugang zu einem strukturierten, evaluierten und zielgruppenspezifischen Schulungsprogramm (DMP) erhalten und ärztlicherseits regelhaft zur Teilnahme an der Schulung motiviert werden. Nachschulungen sind nach spätestens zwei Jahren sinnvoll.6.5. Ernährung
Die Ernährung sollte mit Blick auf das Gewicht des Patienten angepasst werden. Bei Übergewichtigen führt eine Gewichtsreduktion zu einer Besserung der Atemtechnik und einer leichteren Bewältigung anfallender körperlicher Aktivitäten. Auch eine physiotherapeutisch angeleitete Atemtherapie ist sinnvoll.Fazit für die Praxis
In die Therapie der COPD sollte der Präventionsgedanke zunehmend Eingang finden. Vorrangiges Ziel muss es sein, die Mortalität zu senken. Es gilt deshalb, Patienten mit einer COPD so früh wie möglich zu erkennen und nach umfassender Anamnese entsprechend den Empfehlungen von GOLD bestmöglich zu behandeln. Erfasst werden müssen dabei die Häufigkeit der Exazerbationen, das Ausmaß der Lungenfunktionseinschränkung sowie die Komorbiditäten. Steht die Dyspnoe im Vordergrund, geht es darum, die Symptome zu verbessern. Hier sollte schon früh eine duale Bronchodilatation mit einer LAMA/LABA-Fixkombination ins Auge gefasst werden. Treten dagegen Exazerbationen gehäuft auf, muss eine Reduktion erreicht werden. Denn Exazerbationen gehen nachweislich mit einer erhöhten Mortalität einher. Je häufiger sie sind, umso mehr steigt das Risiko. Werden sie reduziert, lässt sich auch die Sterblichkeit senken. Besonders effektiv gelingt die Reduktion von Exazerbationen durch ICS. Patienten, die von ICS profitieren, sollten deshalb baldmöglichst identifiziert und auf eine ICS/LAMA/LABA-Dreifachfixkombination umgestellt werden. Große Untersuchungen wie die IMPACT- und die ETHOS-Studien konnten inzwischen zeigen, dass sich so nicht nur die Exazerbationen reduzieren lassen, sondern auch die Mortalität sinkt. Laut GOLD ist der Wechsel auf eine Dreifachkombination angezeigt bei mindestens zwei moderaten COPD-Exazerbationen pro Jahr oder einer Hospitalisation wegen einer Exazerbation in der Anamnese, bei einer Bluteosinophilenzahl > 300 Zellen/µl oder bei begleitendem Asthma oder einer früheren Asthmadiagnose. Da Patienten mit COPD meist an kardiovaskulären Erkrankungen sterben, ist bei COPD immer eine kardiovaskuläre Risikostratifizierung sinnvoll. Trotz des nachgewiesenen Benefits werden aktuell immer noch zu wenig Patienten, die ein ICS benötigen, damit versorgt. Das sollte sich ändern. Bei der Wahl des ICS kann FF auf einen hohen therapeutischen Index verweisen, sprich eine hohe Wirksamkeit bei geringeren systemischen Nebenwirkungen. Unter ICS können Pneumonien auftreten, die inzwischen als Klasseneffekt identifiziert werden konnten. Begleitet werden muss die medikamentöse Therapie mit nicht-pharmakologischen Maßnahmen. Entscheidend ist der Verzicht auf Tabak, die Durchführung eines körperlichen Bewegungstrainings, aber auch die regelmäßige Kontrolle der Therapieadhärenz. Sie sollte durch Inhalatoren mit einer möglichst einfachen Inhalationstechnik erleichtert werden.* ELLIPTA®
Literatur
1. www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary-disease-(copd)
2. www.lungeninformationsdienst.de/krankheiten/copd/verbreitung/index.html
3. Buist AS et al. Lancet 2007; 370: 741-750
4. Halbert RJ et al. Eur Respir J 2006; 28: 523-532
5. www.awmf.org/leitlinien/detail/ll/020-006.html
6. Soler-Cataluna JJ et al. Thorax 2005; 60: 925-931
7. Rothnie KT et al. Am J Resp Crit Care Med. 2018; 128: 464-471
8. Donaldson GC et al. Chest 2010; 137: 1091-1109
9. Hartl S et al. Eur Respir J 2016; 47: 113-121
10. Kunisaki AM et al. Am J Respir Crit Care Med 2018; published online
11. Dtsch Arztebl 2019; 116 (12): A-575 / B-474 / C-466
12. Maltais F et al. Resp Res 2019; 238
13. Lipson DA et al. AM J Respir Crit Care Med 2017; 196: 438-446
14. Lipson DA et al. N Engl J Med 2018; 378: 1671-1680; doi:10.1056/NEJMoa1713901
15. Rabe KF et al. N Engl J Med 2020; 383: 35-48
16. Wedzicha J et al. N Engl J Med 2016; 374: 2222-2234
17. Pascoe S et al. ERS 2018; OA2127
18. erj.ersjournals.com/content/52/suppl_62/OA2129
19. Daley-Yates P et al. Br J Clin Pharmacol 2020; doi: 10.1002/bcp.14406
20. www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2019/Ausgaben/34_19.pdf
21. Robert Koch-Institut, Epidemiologisches Bulletin 22. August 2019; Nr. 34
22. van der Palen J et al. NPJ Primary Care Respiratory Medicine 2016; 26 (16079): 1-8
23. Riley J et al. Poster #P4145, ERS Barcelona 2013
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).