Desinfektionsmittel Vorsicht: Resistenzen!
Im Jahr 2016 wurden von der FDA Triclosan und 18 weitere biozide Wirkstoffe für antimikrobielle Waschlotionen im häuslichen Umfeld verboten [1]. Einerseits konnten die Hersteller keinen Beleg für die Wirksamkeit finden, d. h. eine Reduktion von Infektionen im Vergleich zu einfachen Waschlotionen. Andererseits ist insbesondere bei Triclosan inzwischen bekannt, dass die Substanz Resistenzen auslösen und hormonähnliche Effekte haben kann. Deshalb kam die Behörde zu einer insgesamt negativen Nutzen-Risiko-Bewertung. Im Gesundheitswesen werden verschiedene Desinfektionsmittel verwendet, die einer vergleichbaren Bewertung unterzogen werden können. Beginnen wir mit einer beispielhaften Betrachtung von einem häufig eingesetzten bioziden Wirkstoff: Benzalkoniumchlorid.
Beispiel Benzalkoniumchlorid
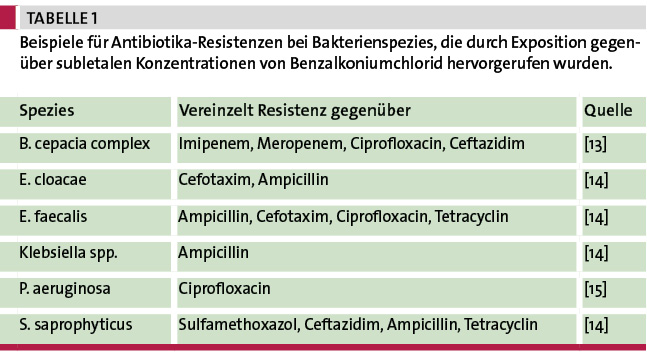
Benzalkoniumchlorid wird häufig als Hauptwirkstoff in Flächendesinfektionsmitteln eingesetzt, findet sich aber vereinzelt auch in niedriger Konzentration in Hautantiseptika oder Händedesinfektionsmitteln. Da viele Daten zu Benzalkoniumchlorid veröffentlicht wurden, bietet es sich an, diesen Wirkstoff beispielhaft zu betrachten. Eine Auswertung von veröffentlichten Daten zur Anpassungsfähigkeit von 78 Bakterienspezies gegenüber subletalen Konzentrationen von Benzalkoniumchlorid zeigte, dass es bei 34 Spezies (44 %) zu einem starken Anstieg der minimalen Hemmkonzentration (MHK) kam. Bei fast der Hälfte dieser Spezies (18 %) war diese starke Anpassung stabil, d. h., dass auch ohne weiteren Selektionsdruck die erhöhte Toleranz erhalten blieb. Unter diesen Spezies finden sich unter anderem E. coli (bis zu 100-facher Anstieg der MHK auf ca. 1.000 mg/l) und P. aeruginosa (bis zu 33-facher Anstieg der MHK auf ca. 2.500 mg/l). E. coli-Isolate mit einer MHK ≥64 mg/l werden als epidemiologisch resistent gegenüber Benzalkoniumchlorid betrachtet. Häufig wurden Kreuztoleranzen gegenüber anderen bioziden Wirkstoffen wie Triclosan oder Chlorhexidin beschrieben. Vereinzelt konnten sogar Resistenzen gegenüber Antibiotika durch subletales Benzalkoniumchlorid ausgelöst werden (Tabelle 1).
Eine Hochregulation von Genen für Transporter und Effluxpumpen wurde in Isolaten von B. cepacia complex, E. coli sowie L. monocytogenes durch Exposition gegenüber subletalen Konzentrationen von Benzalkoniumchlorid ausgelöst. Auch kontaminierte Wirkstofflösungen wurden beschrieben. Ein P. aeruginosa-Stamm war in der Lage, Benzalkoniumchlorid in einer Konzentration von 3.600 mg/l zu widerstehen, und ein Wasserisolat eines Pseudomonas spp. sogar einer Konzentration von 4.000 mg/l [2].
Folgen für die Händedesinfektion
Beachte: Diese Wirkstoffe können zusätzlich zum Alkohol in Händedesinfektionsmitteln vorhanden sein: Benzalkoniumchlorid, Chlorhexidin, Mecetroniumetilsulfat, Octenidin oder Ortho-Phenylphenol [3].
Das Risiko einer Toleranzbildung ist je nach Wirkstoff unterschiedlich groß und für manche Wirkstoffe sogar unbekannt. Und doch bleibt die Frage nach ihrem Nutzen. Weder zur hygienischen noch zur chirurgischen Händedesinfektion wurde jemals unter Anwendungsbedingungen eine klinisch relevante Wirksamkeit remanenter Wirkstoffe nachgewiesen, die signifikant über die der Alkohole hinausgeht [3]. Ein Patientennutzen wurde noch nie nachgewiesen, was auch die WHO in ihrer Empfehlung zur Prävention postoperativer Wundinfektionen für Chlorhexidin in alkoholischen Händedesinfektionsmitteln bestätigt [4]. Deshalb ist die Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention am Robert Koch-Institut (KRINKO) nur sinnvoll und sollte konsequent umgesetzt werden (s. Kasten unten).
Folgen für die Hautantiseptik
Beachte
: Diese Wirkstoffe können zusätzlich zum Alkohol in Hautantiseptika vorhanden sein: Benzalkoniumchlorid, Chlorhexidin, Octenidin oder PVP-Iod [5].
Das Risiko der stabilen Toleranzbildung ist besonders bei Benzalkoniumchlorid und Chlorhexidin hoch. Für Octenidin und PVP-Iod liegen bislang nur wenige Daten vor. Ein Nutzen wurde für 2 % Chlorhexidin in 70 % Iso-Propanol zur Hautantiseptik vor Operationen belegt (signifikant weniger postoperative Wundinfektionen), weshalb diese Kombination von der WHO empfohlen wird [4]. Ein Nutzen ist auch für Chlorhexidin in Alkohol zur Prävention Katheter-assoziierter Septikämien belegt [6].
Tipp
Das ideale Händedesinfektionsmittel enthält "nur" eine ausreichend wirksame Konzentration an Alkoholen, Hautpflegestoffen und Wasser, verfügt über eine hohe Akzeptanz beim Anwender und eine gute Hautverträglichkeit, insbesondere bei häufiger Anwendung. Auf weitere biozide Wirkstoffe, Duftstoffe oder Farbstoffe sollte bewusst verzichtet werden.
Tipp
In alkoholischen Hautantiseptika sollten "remanente" Wirkstoffe in angemessener Konzentration enthalten sein, wenn für diese ein Patientennutzen belegt oder sehr wahrscheinlich ist. Alkoholische Präparate mit niedrig dosiertem Benzalkoniumchlorid weisen für das Benzalkoniumchlorid nach heutigem Erkenntnisstand eine negative Nutzen-Risiko-Bewertung auf.
Für Octenidin (0,1 %) ist ein Patientennutzen möglich, nämlich zur Prävention Katheter-assoziierter Septikämien. Zur Prävention postoperativer Wundinfektionen liegen bislang keine Erkenntnisse vor [6]. Ein alkoholisches Hautantiseptikum mit Benzalkoniumchlorid zeigt auf der Haut keine nennenswerte antimikrobielle Wirkung im Sinne einer remanenten Wirkung, auch ein Patientennutzen ist nicht nachgewiesen [6].
Folgen für die Flächendesinfektion
Beachte
: Diese Wirkstoffe können in Flächendesinfektionsmitteln vorhanden sein: Alkohole, Benzalkoniumchlorid, DDAC, Glutaraldehyd, Natriumhypochlorit, Peressigsäure bzw. Wasserstoffperoxid [7].
Tipp
Das ideale Flächendesinfektionsmittel enthält vorzugsweise Wirkstoffe, die keinen oder nur einen geringen Selektionsdruck ausüben. Flüchtige Wirkstoffe (Alkohole) oder autokatalytische Wirkstoffe (Peroxide, Natriumhypochlorit) sind nach heutigem Stand vorteilhaft im Vergleich zu Benzalkoniumchlorid oder DDAC. Auf eine vergleichbare Wirksamkeit und Materialverträglichkeit ist zu achten.
Den insgesamt größten Selektionsdruck übt Benzalkoniumchlorid aus, gefolgt von DDAC. Bei beiden Wirkstoffen finden sich bei relativ vielen Spezies starke Veränderungen der MHK. Die Datenlage bei Glutaraldehyd, Natriumhypochlorit, Peressigsäure bzw. Wasserstoffperoxid ist deutlich dünner. Doch finden sich nach subletaler Exposition bislang keine starken und stabilen Toleranzen gegenüber den jeweiligen Wirkstoffen. Insbesondere Peressigsäure fällt dadurch auf, dass die Exposition gegenüber subletalen Konzentrationen die Biofilmbildung reduziert, wohingegen bei den anderen Wirkstoffen auch eine Erhöhung der Biofilmbildung bei einigen Spezies beobachtet wurde [7]. Der Nutzen der Flächendesinfektion ist in ausgewählten klinischen Situationen durch niedrigere Infektionsraten belegt [8–10].
Fazit
Auch biozide Wirkstoffe können in subletaler Konzentration in unterschiedlichem Ausmaß zu Toleranzen und vereinzelt sogar zu Antibiotikaresistenzen führen. Deshalb ist es wichtig, konsequent auf die Wirkstoffe in Desinfektionsmitteln zu verzichten, für die kein Nutzen nachgewiesen ist, sie aber nachweislich die Resistenzbildung begünstigen (Antiseptic stewardship).
Empfehlungen der KRINKO
Hygienische Händedesinfektion: Präparate mit Zusatz antimikrobiell remanent wirksamer Wirkstoffe sind nicht zu empfehlen, da dadurch keine verbesserte Wirksamkeit erreichbar ist, aber das Risiko von Nebenwirkungen ansteigt [11].
Chirurgische Händedesinfektion: Der Zusatz eines remanent wirksamen Antiseptikums ist nicht erforderlich und erhöht das Risiko von Nebenwirkungen [12].
1. Department of Health and Human Services; Food and Drug Administration. Safety and Effectiveness of Consumer Antiseptics; Topical Antimicrobial Drug Products for Over-the-Counter Human Use Fed Reg. 2016;81(172):61106-30.
2. Adair FW, Geftic SG, Gelzer J. Resistance of Pseudomonas to quaternary ammonium compounds. I. Growth in benzalkonium chloride solution. Appl Microbiol. 1969;18(3):299-302.
3. Kampf G. Antiseptic Stewardship for Alcohol-Based Hand Rubs. In: Kampf G, editor. Antiseptic Stewardship: Biocide Resistance and Clinical Implications. Cham: Springer International Publishing; 2018. p. 643-50.
4. WHO. Global guidelines for the prevention of surgical site infections. Geneva: WHO; 2016.
5. Kampf G. Antiseptic Stewardship for Skin Antiseptics. In: Kampf G, editor. Antiseptic Stewardship: Biocide Resistance and Clinical Implications. Cham: Springer International Publishing; 2018. p. 651-60.
6. Kampf G. Hautantiseptik - neue Erkenntnisse und Empfehlungen. Krankenhaushygiene Up2date. 2017;12(2):143-55.
7. Kampf G. Antiseptic Stewardship for Surface Disinfectants. In: Kampf G, editor. Antiseptic Stewardship: Biocide Resistance and Clinical Implications. Cham: Springer International Publishing; 2018. p. 661-9.
8. Apisarnthanarak A, Zack JE, Mayfield JL, Freeman J, Dunne WM, Little JR et al. Effectiveness of environmental and infection control programs to reduce transmission of Clostridium difficile. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2004;39:601-2.
9. Chmielarczyk A, Higgins PG, Wojkowska-Mach J, Synowiec E, Zander E, Romaniszyn D et al. Control of an outbreak of Acinetobacter baumannii infections using vaporized hydrogen peroxide. J Hosp Infect. 2012;81(4):239-45. doi:10.1016/j.jhin.2012.05.010.
10. Mayfield JM, Leet T, Miller J, Mundy LM. Environmental control to reduce transmission of Clostridium difficile. Clinical Infectious Diseases. 2000;31:995-1000.
11. KRINKO am Robert Koch Institut. Händehygiene in Einrichtungen des Gesundheitswesens. Bundesgesundheitsbl. 2016;59(9):1189-220.
12. KRINKO am Robert Koch Institut. Prävention postoperativer Wundinfektionen. Bundesgesundheitsblatt. 2018;61(4):448-73.
13. Knapp L, Rushton L, Stapleton H, Sass A, Stewart S, Amezquita A et al. The effect of cationic microbicide exposure against Burkholderia cepacia complex (Bcc); the use of Burkholderia lata strain 383 as a model bacterium. J Appl Microbiol. 2013;115(5):1117-26. doi:10.1111/jam.12320.
14. Gadea R, Fernandez Fuentes MA, Perez Pulido R, Galvez A, Ortega E. Effects of exposure to quaternary-ammonium-based biocides on antimicrobial susceptibility and tolerance to physical stresses in bacteria from organic foods. Food microbiology. 2017;63:58-71. doi:10.1016/j.fm.2016.10.037.
15. Mc Cay PH, Ocampo-Sosa AA, Fleming GT. Effect of subinhibitory concentrations of benzalkonium chloride on the competitiveness of Pseudomonas aeruginosa grown in continuous culture. Microbiology (Reading, England). 2010;156(Pt 1):30-8. doi:10.1099/mic.0.029751-0.
Autor:

Universitätsmedizin Greifswald
Ferdinand-Sauerbruch-Straße
17475 Greifswald
Interessenkonflikte: Der Autor war bis 2016 Angestellter der Bode Chemie GmbH, Hamburg.
Erschienen in: Der Allgemeinarzt, 2019; 41 (7) Seite 74-76
Dieser Beitrag wurde ursprünglich auf doctors.today publiziert.