Stents, Klappen und Coils Eine unheilvolle Interaktion
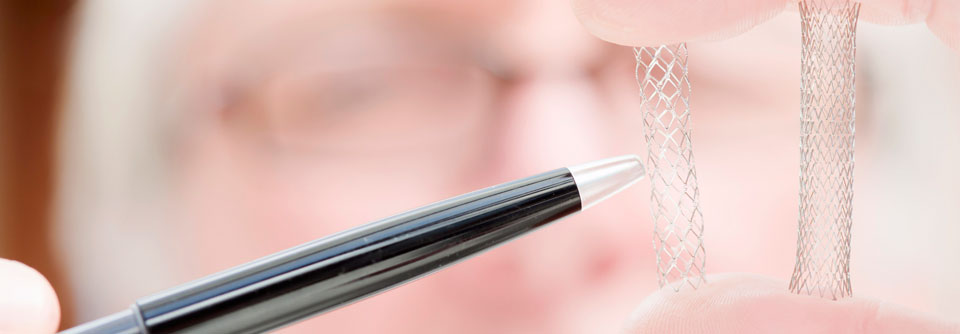
 Stenosen zentraler Atemwege nach Lungentransplantation werden mithilfe von Stents behandelt.
© alexlmx – stock.adobe.com
Stenosen zentraler Atemwege nach Lungentransplantation werden mithilfe von Stents behandelt.
© alexlmx – stock.adobe.com
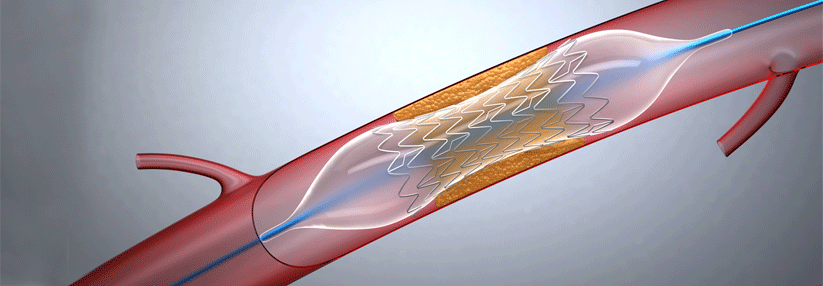
Stents kommen in der Pneumologie zum Einsatz, um benigne und maligne Stenosen zentraler Atemwege, Fisteln und Anastomosenkomplikationen nach Lungentransplantation zu behandeln. Einwegklappen und endobronchiale Coils werden bei Emphysem mit Überblähung eingesetzt, beide mit dem Ziel einer Lungenvolumenreduktion. Langfristig kann jedoch die Wirksamkeit der Implantate durch die Reaktion des umgebenden Gewebes, d.h. durch Bildung von Granulationsgewebe, beeinträchtigt werden.
So verursacht jede Implantation einen kleinen lokalen Gewebeschaden, der zu einer Interaktion des Immunsystems mit dem Device führt, schreiben Sharyn A. Roodenburg und Kollegen vom University Medical Centre, Groningen. Auf diesem bildet sich zunächst eine Matrix von Proteinen, deren Zusammensetzung unter anderem von der Oberfläche des Device abhängt. In der akuten Entzündungsphase, die maximal eine Woche andauert, kommt es zur Infiltration mit Neutrophilen. Der proinflammatorische Status lockt Monozyten und Lymphozyten an, die chronische Entzündungsphase beginnt. Makrophagen wandern ein und bilden z.T. Fremdkörperriesenzellen. Entzündungs- und Fremdkörperreaktion ziehen wiederum Fibroblasten und Endothelzellen an. Diese bilden Kollagen und andere extrazelluläre Matrixproteine, aus denen sich das Granulationsgewebe um das Implantat herum zusammensetzt. Die Stärke der initialen Entzündungsreaktion bestimmt das Ausmaß der Granulation.
Mit dem Einsetzen des Device nimmt die Kolonisierung durch Mikroorganismen zu. Wie dies allerdings die Bildung von Granulationsgewebe in vivo beeinflusst, weiß man nicht. Die bisher bekannten, kleinen, meist kulturbasierten und retrospektiven Studien lassen keine klare Schlussfolgerung zu, schreiben die Reviewautoren. Da das Gewebe der Luftwege bei der Inspiration gedehnt wird, kommt es zur mechanischen Reibung zwischen Implantat und Gewebe – vor allem am proximalen Ende eines Stents – und zur fortwährenden Schädigung. Man vermutet, dass sich deshalb vermehrt Granulationsgewebe bildet. Ein weiterer Faktor, der die Bildung von Granulationsgewebe stimuliert, ist der Druck, den jedes Device auf die Atemwegsmukosa ausübt. Auch mit seiner Größe nimmt der Druck auf die Wand zu.
Immunsuppressiva mit protektivem Effekt?
Geschädigte Zellen können molekulare Signale entsenden, sog. damage-associated molecular patterns (DAMPs), welche das angeborene Immunsystem aktivieren und so ebenfalls zur Bildung von Granulationsgewebe beitragen. Von den patientenbezogenen Faktoren hat die medikamentöse Therapie besondere Bedeutung. Patienten, die Immunsuppressiva (z.B. nach Lungentransplantation) erhalten, entwickeln einer Studie zufolge weniger Granulationsgewebe. Ähnlich wie bei der Keloidbildung kann auch das Wachstum von Granulationsgewebe aufgrund einer genetischen Suszeptibilität aus dem Ruder laufen. Welche genetischen Faktoren dabei im Spiel sind, muss nach Aussage der Autoren noch weiter erforscht werden.
Quelle: Roodenburg SA et al. Eur Respir Rev 2021; 30: 210066; DOI: 10.1183/16000617.0066-2021