COPD Ja zur Früherkennung!
 Auch wenn die Spirometrie normal erscheint, weisen 10–15 % der Raucher pulmonale Auffälligkeiten in der Bildgebung auf. (Agenturfoto)
© Victor Koldunov – stock.adobe.com
Auch wenn die Spirometrie normal erscheint, weisen 10–15 % der Raucher pulmonale Auffälligkeiten in der Bildgebung auf. (Agenturfoto)
© Victor Koldunov – stock.adobe.com
Fest steht, eine einzelne Lungenfunktionsprüfung ist als Früherkennungsmaßnahme unzureichend. Mit ihr lässt sich nicht unterscheiden, ob es sich um eine leichte COPD handelt, die nach initialem FEV1-Abfall stabil verläuft, oder um eine Funktionseinschränkung aufgrund eines neonatalen oder frühkindlichen Organschadens oder um eine typische COPD mit kontinuierlichem FEV1-Abfall, der zügig die Schwelle zum Pathologischen überschreiten wird.
Keine klare Definition für die frühe COPD
Ein Problem sieht Professor Dr. Robert Bals vom Universitätsklinikum des Saarlandes in Homburg zudem darin, dass für die „frühe“ COPD unterschiedliche Definitionen kursieren. Mal wird ein Mindestalter gefordert, mal Bildgebungsbefunde oder ein beschleunigter Abfall der FEV1. Eine Definition stützt sich auf die Symptome, die andere auf die Rauchanamnese. Für die tägliche Praxis bietet es sich wahrscheinlich an, typische Symptome bei relativ guter Lungenfunktion, aber mit Verschlechterung über die Zeit als Kriterien zu nehmen, meinte Prof. Bals. Infrage kommen neben Symptomkonstellation, Lungenfunktion und DLCO die Bildgebung oder Biomarker aus dem Labor. Bei Letzteren konnte sich der Kollege kurz fassen: „Wir kennen keinen einzigen Blutbiomarker, der es erlaubt, den Verlauf vorherzusagen.“
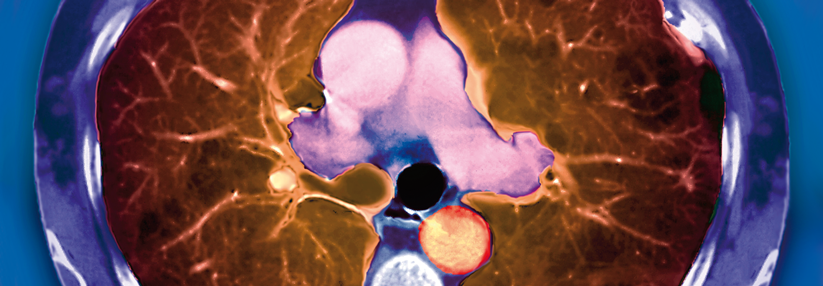
Selbst wenn sie (noch) keine Obstruktion haben, berichten symptomatische Raucher über Einschränkungen von Lebensqualität und Aktivität, über Medikamentengebrauch und sogar Exazerbationen. In der Bildgebung finden sich auch bei unauffälliger Spirometrie oft Zeichen von Atemwegsschäden, Überblähung und/oder Emphysem. Dies ist bei immerhin 10–15 % der Raucher der Fall.
Das Dumme daran: Diese Patienten büßen im Vergleich zu Rauchern ohne Husten, Atemnot und Auswurf zwar schneller Lungenfunktion ein und mehr von ihnen entwickeln später eine manifeste COPD. Es sind aber nicht so viel mehr, als dass sich die Symptomatik als prädiktiver Marker nutzen ließe. Unter Patienten mit normalem Spirometriebefund finden sich nicht wenige mit deutlich eingeschränkter Diffusionskapazität. Möglicherweise lässt sich diese Konstellation nutzen, um Risikokandidaten herauszufischen. Die Früherkennungschancen dürften sich aus Sicht von Prof. Bals verbessern, wenn das Lungenkrebsscreening etabliert ist. Quasi nebenbei könne man auch die Lungendichte beurteilen, die zusätzliche prognostische Informationen liefere.
Die nächste Frage stellt sich dann hinsichtlich der Therapie. Raucherentwöhnung und vermehrte körperliche Aktivität sind für alle Raucher unabhängig vom individuellen COPD-Risiko gut. Studien mit Inhalativa, vor allem LAMA und ICS, zeigen z.T. einen Effekt auf die FEV1, der aber meist gering ausfällt. Trotzdem, die Frühintervention ist angesichts drohender Strukturschäden ein wichtiger Ansatz, der allerdings, so Prof. Bals, noch stärker beforscht werden müsste.
Kongressbericht: 61. Kongress der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin (Online-Veranstaltung)