BfArM warnt: gefälschtes Harvoni® im Umlauf
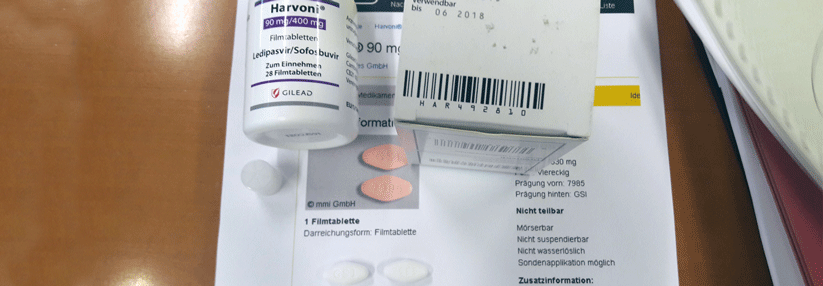 Die gefälschten Tabletten des Arzneimittels Harvoni® unterscheiden sich vom Original nur durch die weiße Farbe.
© BfArM
Die gefälschten Tabletten des Arzneimittels Harvoni® unterscheiden sich vom Original nur durch die weiße Farbe.
© BfArM
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat per Eilmeldung bekannt gegeben, dass eine Fälschung des Hepatitis-C-Medikaments Harvoni® auf den deutschen Markt gelangt ist.
Tabletten sind weiß statt orange
Die gefälschten Tabletten sind nicht wie üblich orange, sondern weiß. Die Packungen tragen die Chargenbezeichnung 16SFC021D (Verfallsdatum 06/2018), bei der es sich um eine real existierende Charge für den deutschen Markt handelt. Die gefälschten Tabletten unterscheiden sich vom Original nur durch die weiße Farbe. Die Verpackung der Tabletten sowie die Tablettenform und -prägung entsprechen dem Original.
Inhalt und Herkunft der Fälschung noch unbekannt
Entdeckt wurde die Fälschung von einem Patienten in Nordrhein-Westfalen, der sie seiner Apotheke meldete. Der Inhalt der Tabletten und ihre Herkunft werden derzeit untersucht. Dem BfArM ist daher noch nicht bekannt, welche Stoffe die anders aussehenden Tabletten enthalten und ob mit der Einnahme gesundheitliche Risiken verbunden sind.
Patienten, die das Arzneimittel Harvoni® 90 mg / 400 mg Filmtabletten der Firma Gilead einnehmen und feststellen, dass es sich dabei um weiße Tabletten handelt, sollen diese keinesfalls einnehmen, sondern sich an ihren behandelnden Arzt oder ihren Apotheker wenden, um das weitere Vorgehen mit ihm abzusprechen.
Für den Austausch des Medikaments muss eine ärztliche Verschreibung bei der Apotheke vorgelegt werden. Apotheker werden darauf hingewiesen, die Farbe der Filmtabletten zu prüfen und im Falle einer Fälschung die üblichen Meldewege einzuhalten. Das BfArM steht in engem Kontakt mit den Landesbehörden, die in Deutschland für die Überwachung des Verkehrs mit Arzneimitteln zuständig sind, sowie mit der Europäischen Arzneimittelbehörde.
Regulär enthält das Arzneimittel Harvoni® 90 mg / 400 mg Filmtabletten die Wirkstoffkombination Ledipasvir und Sofosbuvir und wird bei Erwachsenen zur Behandlung der chronischen Hepatitis C (CHC) angewendet.
Quelle: Pressemitteilung des BfArM vom 01.06.2017.















