
Den Muskelschwund überwinden
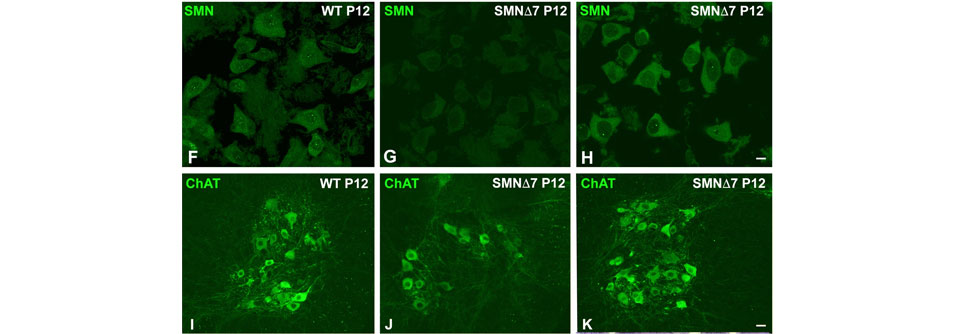 Das typische Färbemuster für die Detektion von SMN zeigt sich bei Mäusen vom Wildtyp (oben links) ebenso wie im SMA-Mausmodell nach einer Behandlung mit Nusinersen (oben rechts). Bei unbehandelten Tieren findet man dagegen ein schwächeres zytoplasmatisches Signal (oben Mitte). Ein ähnliches Bild ergibt sich für die Immunodetektion von Cholinacetyltransferase (ChAT) im Vorderhorn mit und ohne Nusinersen-Therapie (untere Reihe rechts vs. Mitte, links der Wildtyp).
© aus Berciano MT et al. Sci Rep 2020; doi: 10.1038/s4159 8-020-67569 -3; CC-BY 4.0 (Bearbeitung: Medical Tribune)
Das typische Färbemuster für die Detektion von SMN zeigt sich bei Mäusen vom Wildtyp (oben links) ebenso wie im SMA-Mausmodell nach einer Behandlung mit Nusinersen (oben rechts). Bei unbehandelten Tieren findet man dagegen ein schwächeres zytoplasmatisches Signal (oben Mitte). Ein ähnliches Bild ergibt sich für die Immunodetektion von Cholinacetyltransferase (ChAT) im Vorderhorn mit und ohne Nusinersen-Therapie (untere Reihe rechts vs. Mitte, links der Wildtyp).
© aus Berciano MT et al. Sci Rep 2020; doi: 10.1038/s4159 8-020-67569 -3; CC-BY 4.0 (Bearbeitung: Medical Tribune)
Die geschätzte Inzidenz der spinalen Muskelatrophie (SMA) liegt in Europa zwischen 1:3.900 und 1:12.000. Die Ursache sind fast immer biallelische Deletionen, selten pathologische Varianten des SMN1*-Gens. Beides führt zu einem Mangel an SMN-Protein, das physiologisch ubiquitär vorkommt. Warum insbesondere Motoneuronen im Hirnstamm und im Rückenmark auf das Defizit vulnerabel reagieren, ist bislang noch unklar, schreiben Prof. Dr. Crystal Yeo von der Harvard Medical School in Boston und Kollegen.
Abhängig vom Symptombeginn und ihrem Schweregrad wird die SMA in fünf Typen unterteilt, wobei ein schwererer Phänotyp typischerweise mit einer geringeren Kopienzahl des SMN2-Gens einhergeht. Man geht davon aus, dass die Erkrankung umso früher ausbricht und umso schwerer verläuft, je mehr Motoneuronen irreversibel geschädigt sind.
Alle drei mittlerweile verfügbaren Therapien zielen darauf ab, den Spiegel des SMN-Proteins zu erhöhen. Weil dadurch nur unreife und noch nicht irreversibel geschädigte Motoneuronen gerettet werden können, liegt das günstige Zeitfenster für die Behandlung sehr früh. Auch bei einem präsymptomatischen Therapiestart lässt sich der Ausbruch der Krankheit allerdings nicht verhindern.
Lumbalpunktion, Infusion oder orale Einnahme
Die drei verfügbaren Therapien sind im Einzelnen:
- Nusinersen ist ein Antisense-Oligonukleotid, das per Lumbalpunktion intrathekal verabreicht wird. Nach initial vier Dosen wird alle vier Monate eine weitere Dosis von 12 mg verabreicht. Der Wirkstoff fördert die Produktion von SMN2-mRNA und damit des SMN-Proteins.
- Omnasenogen abeparvovec ist eine Gentherapie. Sie basiert auf einem AAV9-Vektor, der die cDNA für das gesunde SMN1-Gen enthält. Dieser wird einmalig intravenös infundiert. Das Transgen integriert sich nicht in die zelluläre DNA, sondern bleibt episomal in sich nicht teilenden Zellen erhalten.
- Bei Risdiplam handelt es sich um einen „Splicing-Modifier“ für das SMN2-Gen, der ebenfalls zu einer vermehrten Produktion von SMN führt. Er wird täglich oral eingenommen.
Alle drei Wirkstoffe bzw. Therapien wurden in klinischen Studien bei präsymptomatischen sowie bei symptomatischen Patienten (mit sowohl frühem als auch späterem Krankheitsbeginn) untersucht und ihre Effektivität entweder mit unbehandelten Patienten oder einem Placebo verglichen. Bei Säuglingen und Kleinkindern verbessern die Therapien das Überleben und die motorische Funktion. Dabei sind die Erfolge umso größer, je früher die Behandlung beginnt.
Die Ergebnisse der klinischen Studien haben sich nach Einschätzung der Autoren bislang in der praktischen Anwendung der Therapien bestätigt. Allerdings sprechen SMA-Betroffene unterschiedlich gut auf die einzelnen Behandlungen an. In der Praxis erfolgen daher mittlerweile nicht nur Wechsel zwischen den Wirkstoffen, sondern auch kombinierte Behandlungen. Wissenschaftliche Evidenz dazu gibt es noch nicht, Untersuchungen laufen derzeit.
Darüber hinaus mehren sich die Hinweise, dass nicht nur Patienten mit bis zu drei SMN2-Kopien, sondern vermutlich auch Patienten mit vier Kopien von einer Behandlung profitieren. Hier bestehen allerdings noch zahlreiche Unsicherheiten.
Bei Erwachsenen sind die Effekte der Therapien schlechter untersucht und die Ergebnisse weniger eindeutig. Allerdings können bei diesen Patienten auch geringfügige Verbesserungen der Symptome bereits einen großen Effekt auf die Lebensqualität haben, wie die Autoren herausstellen.
Nusinersen und Risdiplam zeigen ein gutes Sicherheitsprofil; bei Nusinersen hängen unerwünschte Ereignisse ganz überwiegend mit der Lumbalpunktion zusammen. Bei der Behandlung mit Omnasemnogen abeparvovec können erhöhte Leberwerte auftreten, die eine Steroidtherapie erforderlich machen. Einzelne Todesfälle in Zusammenhang mit akutem Leberversagen und anderen seltenen Komplikationen wurden berichtet. Das Risiko für Nebenwirkungen nimmt mit dem Alter und dem Gewicht der Betroffenen zu.
Ist das SMN-Protein für alle peripheren Organe wichtig?
Da das SMN-Protein physiologisch nicht nur in Neuronen vorkommt, vermuten die Autoren, dass es auch in anderen Geweben wichtige Funktionen haben könnte. Tatsächlich zeigen Autopsien, Fallstudien und Untersuchungen an Tiermodellen Funktionsstörungen in fast allen peripheren Organsystemen, darunter das Herz-Kreislauf-System, Milz, Magen-Darm-Trakt, Leber, Bauchspeicheldrüse und Nieren. Diese Schädigungen treten möglicherweise dann vermehrt zutage, wenn die Motoneuronen dank der Behandlung besser überleben.
Vor diesem Hintergrund könnte es sich als bedeutsam herausstellen, dass mit Omnasemnogen abeparvovec und Risdiplam Zellen überall im ZNS sowie auch periphere Zellen erreicht werden. Mutmaßlich nimmt der Spiegel des SMN-Proteins nach Behandlung mit Omnasemnogen abeparvovec in sich teilenden Zellen wie Gliazellen oder peripheren Motoneuronen mit der Zeit ab. Dies dürfte bei Risdiplam aufgrund der kontinuierlichen Einnahme nicht der Fall sein. Nusinersen dagegen zielt ausschließlich auf die Erhöhung des SMN-Spiegels im ZNS ab.
* Survival of motor neuron
Quelle: Yeo CJJ et al. Lancet Neurol 2024; 23: 205-218; DOI: 10.1016/S1474-4422(23)00419-2
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).
 Das typische Färbemuster für die Detektion von SMN zeigt sich bei Mäusen vom Wildtyp (oben links) ebenso wie im SMA-Mausmodell nach einer Behandlung mit Nusinersen (oben rechts). Bei unbehandelten Tieren findet man dagegen ein schwächeres zytoplasmatisches Signal (oben Mitte). Ein ähnliches Bild ergibt sich für die Immunodetektion von Cholinacetyltransferase (ChAT) im Vorderhorn mit und ohne Nusinersen-Therapie (untere Reihe rechts vs. Mitte, links der Wildtyp).
© aus Berciano MT et al. Sci Rep 2020; doi: 10.1038/s4159 8-020-67569 -3; CC-BY 4.0 (Bearbeitung: Medical Tribune)
Das typische Färbemuster für die Detektion von SMN zeigt sich bei Mäusen vom Wildtyp (oben links) ebenso wie im SMA-Mausmodell nach einer Behandlung mit Nusinersen (oben rechts). Bei unbehandelten Tieren findet man dagegen ein schwächeres zytoplasmatisches Signal (oben Mitte). Ein ähnliches Bild ergibt sich für die Immunodetektion von Cholinacetyltransferase (ChAT) im Vorderhorn mit und ohne Nusinersen-Therapie (untere Reihe rechts vs. Mitte, links der Wildtyp).
© aus Berciano MT et al. Sci Rep 2020; doi: 10.1038/s4159 8-020-67569 -3; CC-BY 4.0 (Bearbeitung: Medical Tribune)

