Kryptogene Pneumopathie imitiert akute Infektionen
 Aufgrund der häufig auftretenden grippeähnlichen Symptomen wird die COP nicht gleich erkannt.
© Lin D, Geiser T. internistische praxis 2020; 62: 11-18; © Mediengruppe Oberfranken - Fachverlage GmbH & Co. KG, Kulmbach
Aufgrund der häufig auftretenden grippeähnlichen Symptomen wird die COP nicht gleich erkannt.
© Lin D, Geiser T. internistische praxis 2020; 62: 11-18; © Mediengruppe Oberfranken - Fachverlage GmbH & Co. KG, Kulmbach
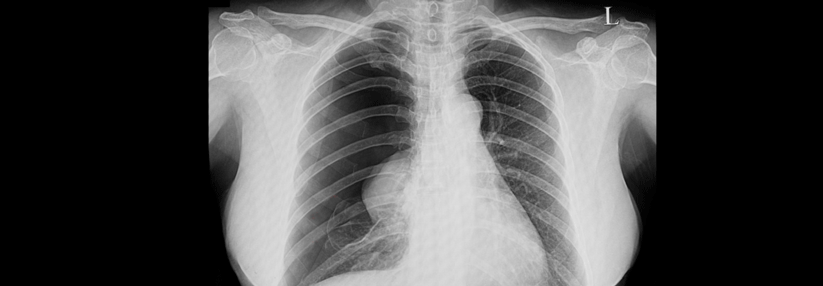
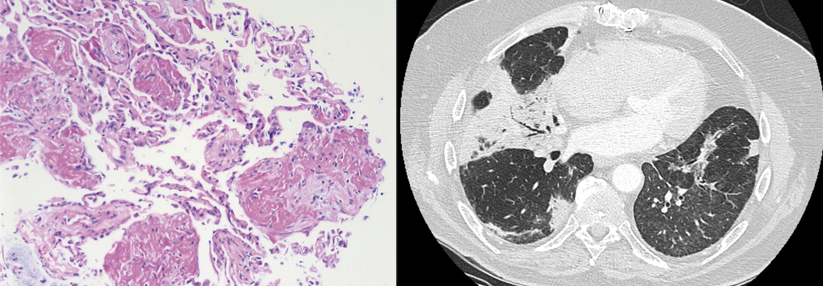
Der Begriff der organisierenden Pneumopathie (OP) beruht auf einem histopathologischen Muster, das Anfang des 20. Jahrhunderts entdeckt wurde. Pathognomonisch ist im Verlauf die Bildung intraalveolärer polypoider, zwiebelschaliger Strukturen aus Granulationsgewebe mit inflammatorischen Zellen, den sogenannten Masson-Körpern. Die Alveolarwände zeigen nur leichte Anzeichen einer Entzündung, die Lungenarchitektur bleibt zumindest im Akut- und Subakutstadium erhalten.
Etwa die Hälfte der Betroffenen leidet zunächst unter grippeähnlichen Symptomen (s. Tabelle). Häufig beginnen diese subakut über Wochen. Klinisch kann bei drei Viertel der Patienten ein Knisterrasseln bestehen, ein Viertel hat…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.