Längeres Überleben als je zuvor
 Insgesamt zeigen sich die Ergebnisse der Phase 1-Studie ernüchternd.
© rzoze19 – stock.adobe.com
Insgesamt zeigen sich die Ergebnisse der Phase 1-Studie ernüchternd.
© rzoze19 – stock.adobe.com
Die Immunsuppression im Uveamelanom wird durch peritumorale Infiltrate mit regulatorischen T-Lymphozyten, myeloischen Suppressorzellen und tumorassoziierten Makrophagen des M2-Typs verursacht, denen nur sehr wenige tumorinfiltrierende Lymphozyten gegenüberstehen. Die M2-Makrophagen exprimieren den Rezeptor für den Kolonie-stimulierenden Faktor 1 (CSF-1R), dessen Ligand CSF-1, ein hämatopoetischer Wachstumsfaktor, wiederum von bestimmten Tumoren exprimiert wird – darunter das Aderhautmelanom.
Der rekombinante humanisierte Antikörper Emactuzumab blockiert CSF-1R und war bei CSF-1-abhängigen diffusen Riesenzelltumoren wirksam. Andere solide Krebsarten sprachen auf eine Monotherapie jedoch nicht an, auch wenn die Konzentration der immunsuppressiven Makrophagen reduziert wurde. In einer Phase-1b-Studie erhielten Patient:innen mit verschiedenen soliden Tumoren Emactuzumab in Kombination mit Atezolizumab. Als einzige Entität sprachen Uveamelanome an, weshalb die Entwicklung des Antikörpers in dieser Kombination eingestellt wurde.
Kolleg:innen um Prof. Dr. Dr. Stéphane Champiat, Gustave Roussy Comprehensive Cancer Center, Villejuif, berichteten nun von einem männlichen Patienten aus der Studie, der an einem Aderhautmelanom im Stadium T3a litt. 14 Monate nach einer Protonenstrahltherapie stellte sich der Mann mit inoperablen Lebermetastasen vor. Die Behandlung mit Dacarbazin hatte lediglich zu einer Stabilisierung der Erkrankung geführt, und nach zweieinhalb Monaten mit Nivolumab war diese wieder progredient. Daraufhin wurde der Patient in die erwähnte Phase-1b-Studie aufgenommen, in der er alle drei Wochen 500 mg Emactuzumab und 1.200 mg Atezolizumab erhielt.
Ungewöhnliche iatrogene Verbreitung eines Uveamelanoms
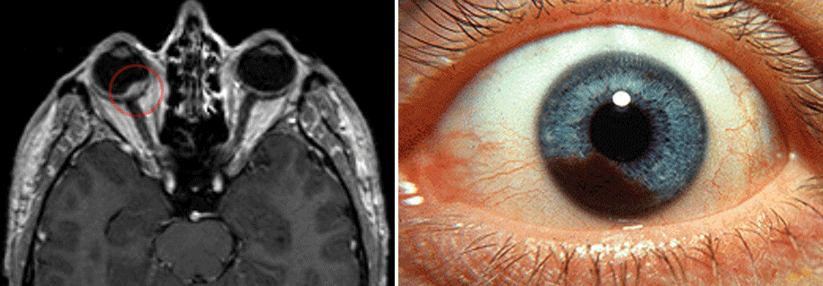
Ophthalmolog:innen um Dr. Hursuong Vongsachang von der Harvard Medical School in Boston berichten in einer Kasuistik über einen ungewöhnlichen Fall von iatrogener Disseminierung eines Uveamelanoms.
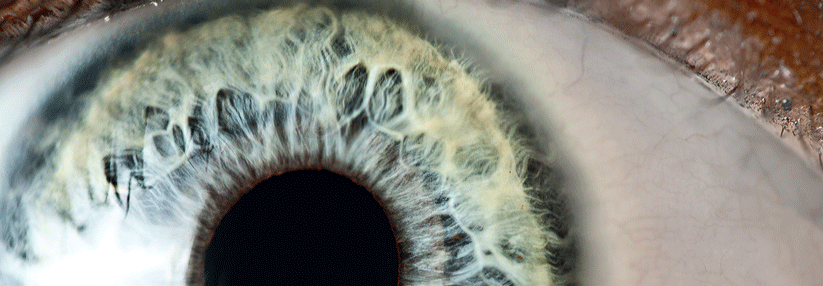
Ein 94-jähriger Mann war aufgrund einer exsudativen altersbedingten Makula-degeneration mindestens sieben Jahre lang mit intravitrealen Injektionen von Aflibercept oder Ranibizumab – Inhibitoren des vaskulären endothelialen Wachstumsfaktors – behandelt worden. Eine Untersuchung wegen zunehmender Visusverschlechterung und Photopsien links ergab äußerlich im inferotemporalen Quadranten tüpfelförmige und leicht erhabene episklerale Verfärbungen mit dilatierten Gefäßen. Im Ultraschall zeigte sich ein pilzförmiger ciliochorioidaler Tumor, der sich in den anterioren Glaskörper erstreckte und beinahe den halben vorderen Augapfel ausfüllte. Wegen der Größe der Läsion und der schlechten visuellen Prognose wurde eine Enukleation des Auges empfohlen.
Bei dem Patienten war zehn Jahre vorher ein kutanes Melanom hinter dem linken Ohr entfernt worden. Nun aber ergab sich histopathologisch eindeutig ein mehr als einen Kubikzentimeter großes Uveamelanom, lokalisiert im Ziliarkörper und mit Ausdehnung in die Choroidea. Die Sklera über dem Tumor enthielt mehrere Narben, die von den intravitrealen Injektionen stammten und intra- wie extraskleral mit Tumorzellen kontaminiert waren. Eine adjuvante Bestrahlung der Orbita wurde erwogen, aber wegen des fortgeschrittenen Alters des Mannes und des ungewissen Nutzens nicht durchgeführt.
Ist ein Uveamelanom im Ziliarkörper lokalisiert, kann die Diagnose von außen schwierig sein, wie der Fall demonstriert: Der Patient hatte des öfteren wegen der Makuladegeneration Untersuchungen mit dilatierter Pupille erhalten. Insbesondere wenn regelmäßig Injektionen auf dem Plan stehen, sollte deshalb sorgfältig untersucht werden, um gegebenenfalls eine Verschleppung von Tumorzellen zu vermeiden.
Quelle: Vongsachang H et al. JAMA Ophthalmol 2023; 141: 801-803; DOI: 10.1001/jamaophthalmol.2023.2521
Bereits nach drei Monaten erreichte er eine partielle Remission. Nach 30 Monaten folgte allerdings eine Progression in Leber und Milz, sodass die Kombinationstherapie abgesetzt wurde. Die Erkrankung sprach weder auf ein immunstimulierendes Medikament in einer weiteren Phase-1-Studie noch auf zwei weitere Linien von Alkylanzien an. 55 Monate nach Diagnose der Lebermetastasen starb der Patient. Die Überlebenszeit sei weit länger als die bisher beobachtete beim metastasierten Uveamelanom, die sich im Bereich zwischen 10 Monaten und 16 Monaten bewegt, schreiben die Forschenden.
Begleituntersuchungen ergaben Folgendes: In der initialen Biopsie waren, typisch für das metastasierte Aderhautmelanom, kaum tumorinfiltrierende Lymphozyten, aber viele tumorassoziierte M2-Makrophagen zu sehen. Nach Beginn der Kombinationsbehandlung fanden sich hingegen mehr Lymphozyten sowie eine tertiäre lymphoide Struktur, ein Cluster von CD20+ B-Zellen und tumorassoziierten Makrophagen. Diese Gebilde werden für die Erzeugung und Expansion von Immunantworten verantwortlich gemacht und wurden bei zahlreichen Tumoren mit einem besseren Ansprechen auf Zytostatika und zielgerichtete Therapien in Verbindung gebracht. Im Falle des kutanen Melanoms sind sie prädiktiv für ein Ansprechen auf CPI. Außerdem wiesen die Forschenden im Blut des Patienten CD8+ Gedächtnis-T-Zellen nach, die spezifisch für zwei Antigene des Uveamelanoms waren.
Höchstwahrscheinlich, so die Autor:innen, seien die tumorassoziierten Makrophagen für den immunsuppressiven Phänotyp des metastasierten Uveamelanoms verantwortlich. Die Unterbrechung der Interaktion zwischen CSF-1 und seinem Rezeptor durch Emactuzumab könnte die immunregulatorische Aktivität dieser Zellen blockieren. Zudem gibt es Evidenz dafür, dass sie durch die CSF-1R-Hemmung zu einem gegen den Tumor gerichteten M1-Phänotyp reprogrammiert werden.
In Studien der Phase 1, resümieren die Kolleg:innen, lohne es sich also, auf ein Ansprechen einzelner, wenngleich seltener Entitäten zu achten, selbst wenn die Ergebnisse insgesamt enttäuschend ausfallen.
Quelle: Champiat S et al. JCO Precision Oncol 2023; 7: e2200363; DOI: 10.1200/PO.22.00363
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).