Cartoon Medizin und Markt
Phase-3-Daten von Bimekizumab zeigen klinisch bedeutsames, tiefgreifendes und anhaltendes Ansprechen über 48 Wochen
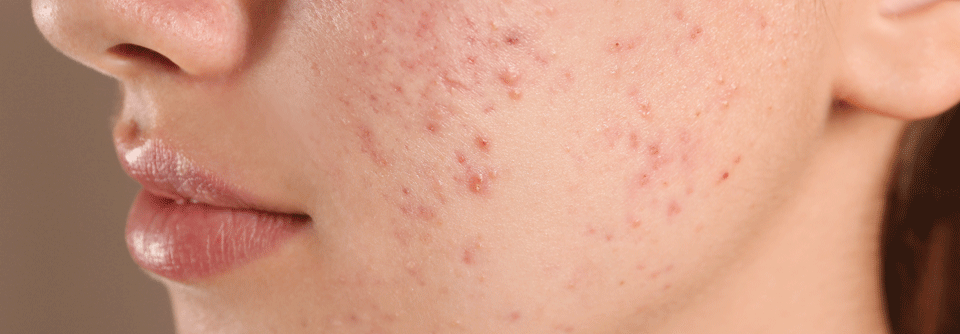
 Hidradenitis suppurativa (HS) ist eine chronische, wiederkehrende, schmerzhafte und schwächende, entzündliche Hauterkrankung.
© syahrir – stock.adobe.com
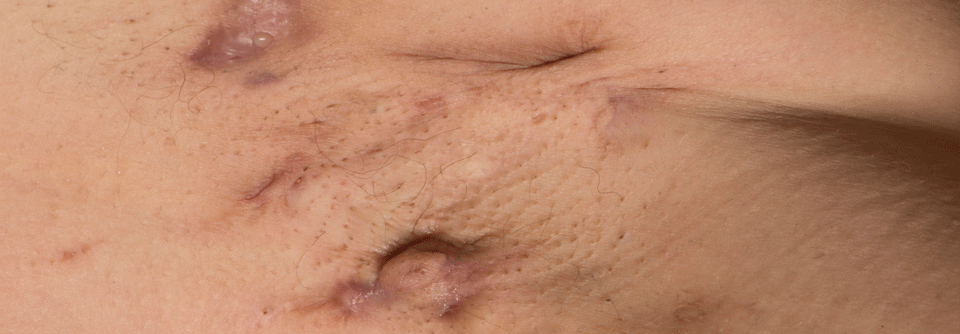
Hidradenitis suppurativa (HS) ist eine chronische, wiederkehrende, schmerzhafte und schwächende, entzündliche Hauterkrankung.
© syahrir – stock.adobe.com
Die Daten aus den beiden Studien zeigten, dass Bimekizumab im Vergleich zu Placebo statistisch signifikante und konsistente klinisch bedeutsame Verbesserungen bei den Anzeichen und Symptomen von HS in Woche 16 erzielte, die bis Woche 48 anhielten.1,± Das klinische Ansprechen auf Bimekizumab wurde ab der ersten Dosis beobachtet, wobei einige Patient:innen in Woche 4 einen HiSCR50-Wert erreichten.1 Diese neuen Daten wurden im Rahmen einer Late-Breaking-Plattform-Präsentation auf der Jahrestagung 2023 der American Academy of Dermatology (AAD) in New Orleans, USA, vom 17. bis 22. März vorgestellt.
"Hidradenitis suppurativa ist eine chronische, schwächende, entzündliche Hauterkrankung, für die es derzeit nur eine zugelassene Behandlung gibt", sagte die leitende Prüfärztin Alexa B. Kimball, MD, MPH, Beth Israel Deaconess Medical Center und Professorin für Dermatologie an der Harvard Medical School, Boston, MA, USA. "Die Behandlung mittelschwerer bis schwerer Fälle mit Bimekizumab hat in Phase-3-Studien vielversprechende Ergebnisse gezeigt, mit anhaltender Verbesserung nach einem Jahr."
In den beiden Studien (n=505 in BE HEARD I; n=509 in BE HEARD II) wurden zwei Dosierungsschemata von Bimekizumab (320 mg alle zwei Wochen [Q2W] und 320 mg alle vier Wochen [Q4W]) im Vergleich zu Placebo über die 16-wöchige Initial- und 32-wöchige Erhaltungstherapie untersucht.1 Die auf der AAD 2023 vorgestellten Daten zeigen:
- Ein signifikant höherer Anteil der mit Bimekizumab (Q2W) behandelten Patient:innen erreichte in Woche 16 den primären Endpunkt HiSCR50 im Vergleich zu Placebo in BE HEARD I und BE HEARD II (47,8 Prozent gegenüber 28,7 Prozent [p=0,006] bzw. 52,0 Prozent gegenüber 32,2 Prozent [p=0,003]).1
- In BE HEARD I und BE HEARD II erreichte ein größerer Anteil der mit Bimekizumab (Q4W) behandelten Patient:innen in Woche 16 einen HiSCR50-Wert als unter Placebo, wobei in BE HEARD II eine statistische Signifikanz erreicht wurde (45,3 Prozent vs. 28,7 Prozent [p=0,030] bzw. 53,8 Prozent vs. 32,2 Prozent [p=0,004]).1
- Patient:innen, die mit Bimekizumab behandelt wurden, erreichten ein tiefgreifendes klinisches Ansprechen, wobei ein größerer Anteil von ihnen in Woche 16 HiSCR75, einen wichtigen sekundären Endpunkt, erreichte als unter Placebo, mit statistischer Signifikanz in BE HEARD II mit beiden Dosierungsschemata und für Q2W in BE HEARD I.1
- Bei den mit Bimekizumab behandelten Patient:innen verbesserte sich die gesundheits-bezogene Lebensqualität (Veränderung des dermatologischen Lebensqualitätsindex gegenüber dem Ausgangswert) im Vergleich zu Placebo in Woche 16 (BE HEARD I und BE HEARD II, Q2W und Q4W).1
- Das klinische Ansprechen (HiSCR50 und HiSCR75) blieb bei kontinuierlicher Bimekizumab-Behandlung erhalten – mehr als 75 Prozent der Patient:innen erreichten HiSCR50 und mehr als 55 Prozent HiSCR75 in Woche 48 (Analyse der beobachteten Fälle; BE HEARD I und BE HEARD II, Q2W und Q4W).1
"Heute haben wir auf dem größten Dermatologiekongress des Jahres 48-Wochen-Daten aus unserem Phase-3-Programm mit Bimekizumab bei Hidradenitis suppurativa vorgestellt. Die Ergebnisse des DE-N-BK-HS-2300001 Phase-3-Programms unterstreichen die bedeutsamen klinischen Ergebnisse, die durch die Hemmung von IL-17F zusätzlich zu IL-17A erzielt werden", sagte Emmanuel Caeymaex, Executive Vice President, Immunology Solutions und Head of U.S., UCB. "Wir konzentrieren uns jetzt auf die nächsten Schritte mit den für später in diesem Jahr geplanten globalen Zulassungsanträgen für Bimekizumab bei Hidradenitis suppurativa."
Das Verträglichkeitsprofil von Bimekizumab in BE HEARD I und BE HEARD II stimmte mit früheren Studien überein, wobei keine neuen Verträglichkeitssignale beobachtet wurden.1 Die häufigsten (Häufigkeit von >5 Prozent) behandlungsbedingten unerwünschten Ereignisse unter Bimekizumab über 16 Wochen waren Hidradenitis (7,2 Prozent in BE HEARD I und 8,8 Prozent in BE HEARD II), orale Candidose (4,4 Prozent in BE HEARD I und 6,7 Prozent in BE HEARD II), Kopfschmerzen (7,0 Prozent in BE HEARD I und 5,8 Prozent in BE HEARD II) und Durchfall (7,0 Prozent in BE HEARD I und 5,3 Prozent in BE HEARD II).1
UCB geht davon aus, dass ab dem dritten Quartal 2023 weltweit Zulassungsanträge für Bimekizumab bei mittelschwerer bis schwerer HS eingereicht werden.
In der Europäischen Union und Großbritannien ist Bimekizumab für die Behandlung von mittelschwerer bis schwerer Plaque-Psoriasis bei Erwachsenen, die für eine systemische Therapie in Frage kommen, zugelassen.2,3 UCB erforscht Bimekizumab bei HS. Die Wirksamkeit und Verträglichkeit von Bimekizumab bei HS ist nicht nachgewiesen und es ist von keiner Zulassungsbehörde weltweit für diese Indikation zugelassen.
Quellen:
1 Kimball AB, Zouboulis CC, Sayed C, et al. Bimekizumab in patients with moderate-to-severe hidradenitis suppurativa: 48-week efficacy and safety from BE HEARD I & II, two phase 3, randomized, double-blind, placebo controlled, multicenter studies. Late-Breaking Platform Presentation at the 2023 American Academy of Dermatology Annual Meeting.
2 BIMZELX® (bimekizumab) EU Summary of Product Characteristics, March 2022: https://www.ema.europa.eu/en/documents/product-information/bimzelx-epar-product-information_en.pdf
3 BIMZELX® (bimekizumab) GB Summary of Product Characteristics: https://www.medicines.org.uk/emc/product/12834/smpc#gref
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).