CAR-T-Zellen Welche Mutationen lösen Resistenzen aus?
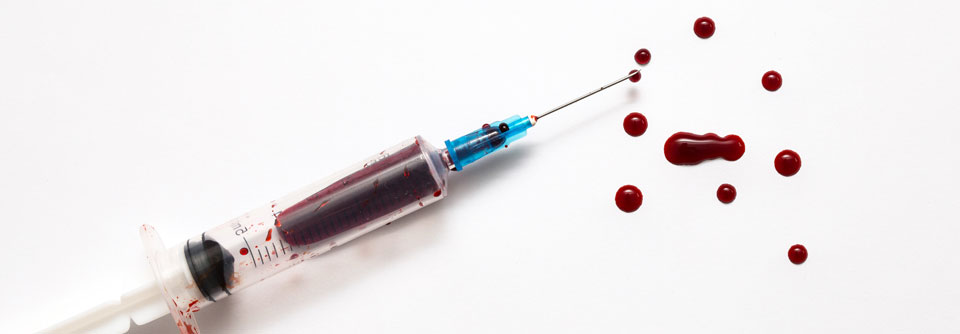 Für das molekularanalytische Verfahren reicht etwas Blut aus – es bedarf keiner invasiven Probenentnahme wie bei einer klassischen Biopsie.
© iStock/cerro_photography
Für das molekularanalytische Verfahren reicht etwas Blut aus – es bedarf keiner invasiven Probenentnahme wie bei einer klassischen Biopsie.
© iStock/cerro_photography
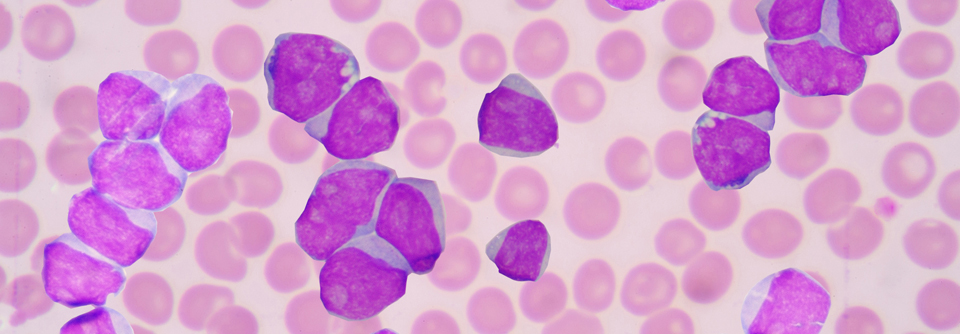
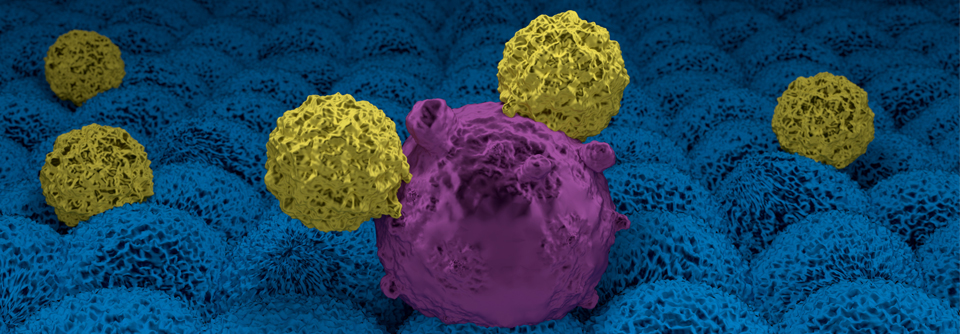
CAR-T-Zellen haben in der Hämatologie neue Möglichkeiten eröffnet, beispielsweise CD19-positive maligne B-Zell-Erkrankungen zu bekämpfen. Diese Zellen sind etwa bei rezidivierten oder refraktären großzelligen B-Zell-Lymphomen (rrLBCL) sehr wirksam. Allerdings entwickeln mehr als die Hälfte der Patienten innerhalb eines Jahres erneut Rezidive. Was für diese Resistenzentwicklung verantwortlich ist, blieb lange Zeit unklar.
Um das Ansprechen vorhersagen zu können und frühzeitig mögliche Hinweise auf eine Resistenz zu finden, waren bisher konsekutive Biopsien erforderlich. Die neuen molekulargenetischen Methoden ermöglichen es jedoch, aus der im peripheren Blut zu findenden zellfreien DNA…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.