Mukoviszidose Kleine Moleküle halten die Lunge frei
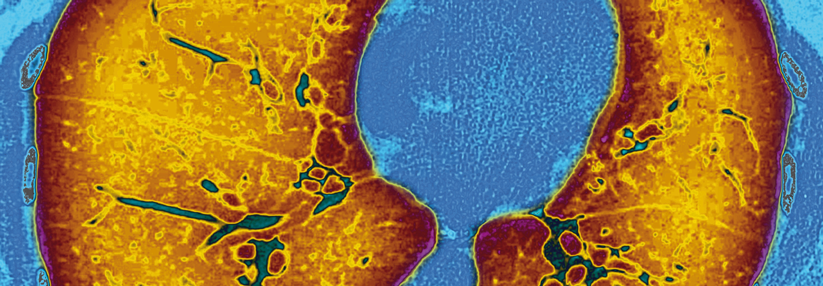
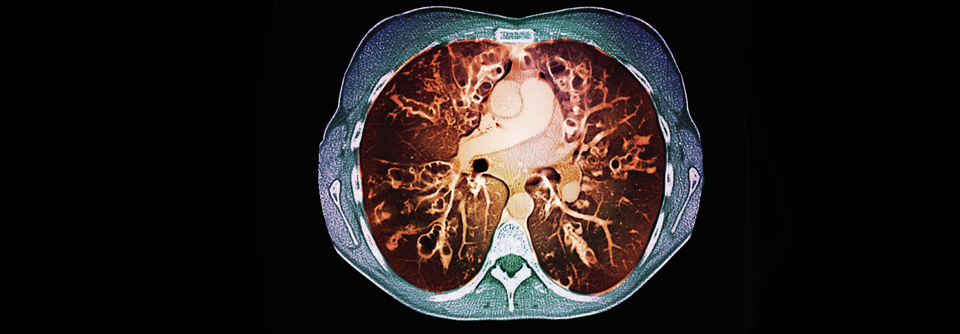
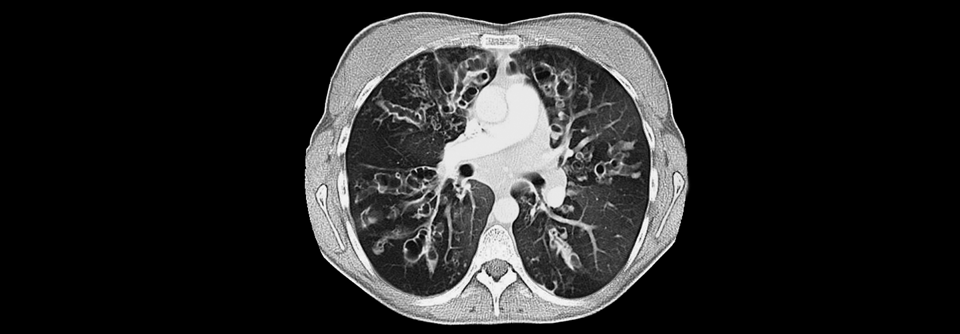 Die CT eines 21-jährigen CF-Patienten: Die pulmonale Schleimansammlung fördert die Entwicklung von Infektionen.
© Science Photo Library/Zephyr
Die CT eines 21-jährigen CF-Patienten: Die pulmonale Schleimansammlung fördert die Entwicklung von Infektionen.
© Science Photo Library/Zephyr
Als Teilnehmer wählten sie Patienten mit zystischer Fibrose und Homozygotie für die Mutation F508del, die zu Beginn der Untersuchung mindestens zwölf Jahre alt waren. Alle erhielten eine duale CFTR-Modulation entweder mit Lumacaftor/Ivacaftor (LUM/IVA) oder mit der Kombination Tezacaftor/Ivacaftor (TEZ/IVA). Die jährlichen Daten für die Jahre 2010 bis 2019 lieferte das niederländische Register für zystische Fibrose.
Eingeschlossen in die Untersuchung waren 401 Patienten im Durchschnittsalter von 25 Jahren. Der Ausgangswert für die Einsekundenkapazität (FEV1) lag im Mittel bei 70,5 % des Sollwerts. Die FEV1-Abnahme wurde mit dem Start der Modulatorbehandlung von -1,36 % auf -0,48 % jährlich abgebremst, was einer Besserung von 0,88 % entspricht. Die stärksten Effekte ließen sich bei Patienten mit niedrigem Ausgangs-FEV1 (< 40 %) erzielen, schreiben Dr. Danya Muilwijk von der Universitätsmedizin Utrecht und Koautoren.
Der BMI wurde bei Erwachsenen durch die Behandlung nicht beeinflusst. Bei Kindern zeigte sich eine Verringerung im BMI-Z-Score um 0,14 % pro Jahr. Die Dauer beim intravenösen Antibiotikabedarf ging zumindest im ersten Jahr der Studie um rund 70 % zurück (Incidence Rate Ratio 0,28).
Aus diesen Ergebnissen schließen die Autoren, dass die Langzeitwirkung der dualen CFTR-Korrektur auf FEV1-Abfall, BMI und Antibiotikabedarf unter Alltagsbedingungen etwas geringer ausfällt als in klinischen Studien gezeigt.
Die Resultate sind dennoch ermutigend, kommentieren Prof. Dr. Anna-Maria Dittrich von der Medizinischen Hochschule Hannover und Dr. Sandra Chuang von der Universität von South Wales in Sydney. Die Studie von Dr. Muilwijk und Kollegen zeige, dass der Abfall der Lungenfunktion nicht nur bei Patienten mit FEV1-Werten zwischen 40 und 90 % gebremst werde, auch Personen mit einem Ausgangs-FEV1 unterhalb von 40 % scheinen von der CFTR-Modulation zu profitieren. Allerdings sei es für eine endgültige Einschätzung der Wirksamkeit unter Alltagsbedingungen noch zu früh.
* cystic fibrosis transmembrane conductance regulator
Quellen:
1. Muilwijk D et al. ERJ Open Res 2022; DOI: 10.1183/23120541.00204-2022
2. Dittrich AM, Chuang SY. ERJ Open Res 2022; DOI: 10.1183/23120541.00464-2022