CUP-Leitlinie Metastasen und kein Primarius in Sicht
 Die neue ESMO-Guideline ermöglicht eine eindeutigere Abgrenzung von CUP Malignomen gegenüber anderen Krebsformen.
© MQ-Illustrations – stock.adobe.com
Die neue ESMO-Guideline ermöglicht eine eindeutigere Abgrenzung von CUP Malignomen gegenüber anderen Krebsformen.
© MQ-Illustrations – stock.adobe.com
Malignome mit unbekanntem Primärtumor machen weniger als 5 % der Krebsdiagnosen aus, sind aber bei den Todesfällen überrepräsentiert. Wie Prof. Dr. Alwin Krämer, Universitätsklinikum Heidelberg, und Kolleg:innen in der neuen ESMO-Leitlinie betonen, hat sich an der schlechten Prognose in den vergangenen Jahren kaum etwas geändert. Das mediane Überleben beträgt drei Monate, 80 % der Betroffenen sterben im ersten Jahr.
Diagnose
Die Diagnosestellung erfordert die histologische und immunhistochemische Untersuchung von qualitativ hochwertigen Gewebsproben (Evidenzgrad III, Empfehlungsgrad A). Zunächst müssen Patholog:innen dabei die Morphologie beurteilen. Bleibt der Befund unklar, können sie die Abstammung durch Immunhistochemie einordnen. Breitspektrumkeratine weisen eine epitheliale Herkunft nach, CD45 einen hämatolymphoiden Ursprung und SOX10 und/oder S100 identifizieren Melanomzellen. Im Falle eines triple-negativen Ergebnisses muss man einen mesenchymalen Ursprung in Betracht ziehen. Danach können, abhängig von den klinischen Befunden, schrittweise weitere Marker untersucht werden.
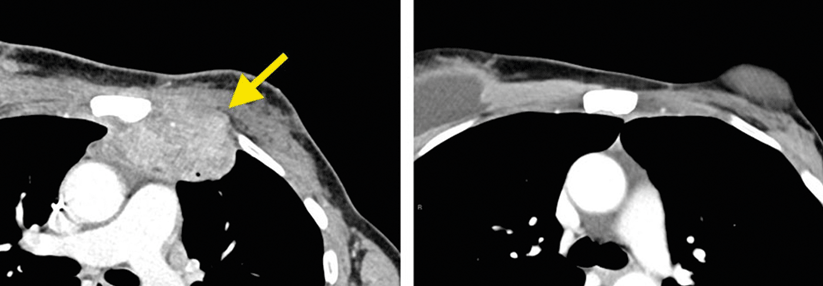
Zur grundlegenden klinischen Diagnostik bei allen Personen mit Verdacht auf CUP gehören eine gründliche Patient:innenhistorie und körperliche Untersuchung sowie Blutbild und -biochemie. Hinzu kommt eine CT mit Kontrastmittel oder eine MRT von Hals, Thorax, Bauchraum und Becken. Bei Frauen sollten die Behandelnden zusätzlich eine Mammografie durchführen.
Eine FDG-PET-CT empfiehlt sich, um weitere Herde auszuschließen, wenn man von einer lokalisierten/ oligometastasierten Erkrankung ausgeht. Außerdem ist sie bei Metastasen in den zervikalen Lymphknoten mit Verdacht auf einen Kopf-Hals-Tumor als Primarius indiziert (IV, B). In allen anderen Fällen kann man dieses Bildgebungsverfahren als optional ansehen (III, C).
Das weitere Vorgehen hängt von der vermuteten Lokalisation und Natur des Primärtumors ab. Die Verfasser:innen der Leitlinie führen eine Reihe von Diagnosealgorithmen auf, anhand derer Ärzt:innen CUP im entsprechenden Gewebe von definierten Entitäten wie NSCLC, intrahepatischen Cholangiokarzinomen sowie Mamma- oder Ovarialtumoren abgrenzen können (V, B). Dies dient auch der Standardisierung für klinische Studien. Haben Patient:innen bereits eine Krebserkrankung überstanden, sollten die Behandelnden einen Rückfall ausschließen (IV, A), im Zweifelsfall durch vergleichende Sequenzierung alter und neuer Gewebsproben.
Ein Panel-NGS kann routinemäßig durchgeführt werden und Angriffspunkte für zielgerichtete Therapien identifizieren (IV, B). In Einzelfällen liefern die entdeckten Mutationen Hinweise auf die Natur des Primarius. Kommt eine Anwendung von Checkpoint-Inhibitoren infrage, empfiehlt es sich, Mikrosatelliteninstabilität, PD-L1 und Mutationslast zu bestimmen (III, B).
CUP mit günstiger Prognose
Etwa 20 % der Patient:innen mit der Diagnose CUP weisen eine prognostisch günstige Form auf. Dabei liegen entweder eine lokalisierte Erkrankung oder Analogien zu definierten Malignomen vor. Hinsichtlich der Definitionen hat sich einiges geändert. Prof. Krämer und Kolleg:innen erweitern die Subgruppe „CUP mit einzelnem Metastaseherd“ um oligometastasierte Fälle mit Potenzial für eine lokale ablative Behandlung. Sie schlagen folgende Definition für Oligometastasierung vor:
- maximal fünf Filiae
- eine lokale Behandlung aller Läsionen scheint praktikabel
- die Oligometastasierung wurde durch PET-CT und MRT des Gehirns bestätigt
- die Erkrankung darf kein diffuses Organ wie Meningealraum oder Pleura betreffen
Neu hinzu kommen erstmals CUP mit einer Ähnlichkeit zum Nierenzellkarzinom (V, C), die von einer Behandlung mit Checkpoint-Inhibitoren und Tyrosinkinase-Inhibitoren profitieren können. Histologie und IHC müssen dabei streng mit Nierenkrebs übereinstimmen, darunter die Immunfärbung für die Nierenmarker PAX8, PAX2, Racemase und CD10.
Es entfallen alle Formen mit neuroendokrinem Profil, hier gelten zukünftig die Empfehlungen für neuroendokrine Tumoren. Der bereits aus der Leitlinie von 2015 gestrichene Subtyp „wenig differenziertes Karzinom mit Verteilung entlang der Mittellinie“ soll nicht mehr verwendet werden, da die meisten Betroffenen an extragonadalen Keimzelltumoren oder, seltener, an aggressiven NUT*-Karzinomen litten.
Bei lokalisiertem CUP sowie oligometastatischer Erkrankung ist eine lokale Therapie mit ablativer Operation und/oder Bestrahlung vorgesehen (IV, B). Für die Subtypen, welche bekannten Krebsentitäten ähneln, orientieren sich die Empfehlungen am vermuteten Primarius. Im Falle eines breast-like CUP sollte über die Mammografie hinaus eine MRT der Brust die Diagnose absichern und ein primäres Mammakarzinom ausschließen (IV, A). Zusätzlich zur systemischen Behandlung raten die Verfasser:innen hier ipsilateral zu einer Bestrahlung oder Entfernung des Brustgewebes.
CUP-Subformen mit besseren Überlebensaussichten
- einzelne Metastase oder oligometastatische Erkrankung, die lokal ablativ behandelt werden kann (single-site or oligometastatic CUP)
- Frauen mit isolierten axillären Lymphknotenmetastasen (breast-like CUP)
- Frauen mit peritonealer Karzinomatose eines serösen, papillären Adenokarzinoms (ovary-like CUP)
- Plattenepithelkarzinom, welches zervikale Lymphknoten außer den supraclavikulären befällt (head and neck-like CUP)
- Männer mit blastischen Knochenmetastasen und/oder hohem PSA (Serum oder IHC) (prostate-like CUP)
- Adenokarzinom mit kolorektaler IHC (CK7–, CK20+, CDX2+) oder passendem molekularem Profil (colon-like CUP)
- Karzinome mit nierenzelltypischer Histologie und IHC (renal-like CUP)
CUP mit ungünstiger Prognose
„CUP mit ungünstiger Prognose“ umfasst alle Fälle, die nicht in eine der prognostisch vorteilhaften Subgruppen fallen. Ausreichend fitte Patient:innen sollten eine Chemotherapie mit niedriger Toxizität erhalten. Prof. Krämer und Kolleg:innen empfehlen, die Prognose auf der Grundlage von ECOG-Status und Serum-LDH zum Zeitpunkt der Erstdiagnose abzuschätzen (IV, A). Die günstigeren Aussichten haben diejenigen, die einen ECOG von 0 oder 1 und LDH im Normalbereich aufweisen. Eine ungünstige Prognose liegt vor, wenn Patient:innen mindestens eine dieser Bedingungen nicht erfüllen.
Im Allgemeinen gilt eine platin-basierte Chemotherapie-Kombination mit einem Taxan oder Gemcitabin als Goldstandard (III, B). Studienergebnisse konnten keine Vorteile für ein Triple-Regime belegen, während dieses gleichzeitig eine höhere Toxizität aufweist. Bisher existieren keine Daten zur Zweitlinie. Ein Wechsel zwischen etablierten Protokollen im Falle einer Progression erscheint den Verfasser:innen jedoch sinnvoll. Alternativ kommen Checkpoint-Inhibitoren und zielgerichtete Therapien infrage.
Für Personen mit einer NTRK-Fusion raten die Expert:innen zur Behandlung mit dem entsprechenden Inhibitor (III, A). Das Gleiche gilt bei einer EGFR-Mutation sowie einer Fusion von ALK oder ROS1 (II, A). Liegt eine BRAFV600E-Mutation vor, stellt ein BRAF-Inhibitor ab der zweiten Linie eine Option dar. Wird der Primärtumor in der Lunge vermutet, darf man diese Strategie auch als Erstlinientherapie erwägen (III, C). Weitere zielgerichtete Behandlungen, welche für andere Indikationen zugelassen sind, können trotz dünner Datenlage Anwendung finden, wenn das Gewebe die entsprechenden Aberrationen aufweist (III, C).
Eine Zweitlinientherapie mit Checkpoint-Inhibitoren kommt bei CUP mit schlechter Prognose in folgenden Fällen infrage:
- Mikrosatelliteninstabilität oder MMR-Defizienz (III, B)
- hohe Mutationslast (III, B)
- hohe PD-L1-Expression (III, C)
Für Patient:innen mit colon-like CUP und MSI-H oder dMMR darf man die Checkpoint-Inhibition schon in der ersten Linie einsetzen (III, B). Die Behandelnden können sie auch dann in Betracht ziehen, wenn die Eigenschaften des Tumors auf eine Entität hinweisen, gegen die die Immuntherapie eine etablierte Option darstellt. Bezüglich der Expression von PD-L1 bleibt noch völlig unklar, welcher Score und welche Grenzwerte sich am besten eignen. Darüber hinaus existieren keine Daten zur Kombination von PD-L1- und CTLA4-Antikörpern.
Es gibt keine Evidenz dafür, dass eine Vorhersage des Ursprungsgewebes auf Basis der Genexpression oder DNA-Methylierung und eine daran orientierte Therapie prognostische Vorteile bringen. Aufgrund der schlechten Überlebensaussichten und des Mangels an Forschungsdaten zum CUP-Syndrom empfehlen die Verfasser:innen allgemein den Einschluss von Patient:innen in klinische Studien (V, A).
Nachsorge
Nachsorgeuntersuchungen (CT/MRT) können gemäß den Expert:innen um Prof. Krämer im Abstand von drei Monaten stattfinden, wenn der/die Erkrankte als fit für weitere Behandlungen eingestuft wird (IV, B). Ein Manko: Es gibt noch keine wissenschaftliche Grundlage für Guidelines zum Langzeit-Follow-up von Patient:innen nach lokalisierter Behandlung einer begrenzten Anzahl von Läsionen (single-site or oligometastatic CUP) in kurativer Intention.
*Nuclear protein in testis
Quelle:
Krämer A et al. Ann Oncol 2022; DOI: 10.1016/j.annonc.2022.11.01
CUPISCO-Ergebnisse heiß ersehnt

Die neue ESMO-Guideline soll eine bessere Abgrenzung von CUP gegenüber anderen Krebserkrankungen ermöglichen. Welche Neuerungen beinhaltet sie im Bezug auf die Diagnostik?
Prof. Dr. Alwin Krämer: Es geht dabei gar nicht so sehr um neue diagnostische Maßnahmen. Die Leitlinie enthält erstmals Algorithmen, um anhand von radiologischen, histologischen und klinischen Kriterien zwischen CUP und sieben häufigen Differenzialdiagnosen zu unterscheiden. Eine typische schwierige Situation ist beispielsweise, bei Raumforderungen in Lunge oder Leber zu entscheiden, ob es sich um Metastasen oder den Primarius handelt. Dies ist natürlich für die Behandlung wichtig, aber auch für den möglichst homogenen Einschluss von CUP-Patient:innen in klinische Studien.
Wie wirkt sich ein schlechter Allgemeinzustand auf die Behandlung aus?
Prof. Krämer: Heute würde man in unseren Augen zunächst einmal die Biopsien aller Patient:innen sequenzieren. Insbesondere mit zielgerichteten Strategien und Immuntherapien kann man, je nachdem, wie gut das Target ist, durchaus auch in reduziertem Allgemeinzustand eine Behandlung versuchen. Mit unspezifischen Chemotherapien würde man sich in diesen Fällen eher zurückhalten.
Herr Professor Krämer, Sie sind maßgeblich an der CUPISCO-Studie beteiligt. Welche Ergebnisse erwarten Sie im Laufe dieses Jahres?
Prof. Krämer: Für die internationale Studie wurden 630 Proband:innen mit neu diagnostiziertem, prognostisch ungünstigem CUP rekrutiert. Im November 2022 konnte die Rekrutierung abgeschlossen werden. Die bereits erwähnten Diagnosealgorithmen stammen aus dem Eligibility Process zu dieser Studie. Wir hatten initial eine Screen Failure Rate von über 50 %, weil häufig letztendlich doch kein CUP-Syndrom vorlag. Das eigentliche Ziel der Studie ist es, bei prognostisch ungünstigem CUP eine zielgerichtete und/oder Immuntherapie mit einer platinbasierten Chemotherapie in der Erstlinie zu vergleichen. Dazu wissen wir Mitte dieses Jahres hoffentlich mehr.
In welchen Bereichen sehen Sie noch den größten Forschungsbedarf?
Prof. Krämer: Der Forschungsbedarf beim CUP-Syndrom ist insgesamt sehr hoch, weil man noch wenig über die Erkrankung weiß. Es gibt nur wenige standardisierte Untersuchungen an größeren, homogenen Patient:innenkollektiven. Sowohl hinsichtlich der Pathogenese als auch zur Diagnostik und Therapie bestehen noch große Wissenslücken, und das wollen wir ändern.
Wo sehen Sie Potenzial für therapeutische Fortschritte und eine Verbesserung der Prognose?
Prof. Krämer: Ich bin optimistisch, dass Immuntherapien und zielgerichtete Behandlungen zukünftig eine größere Rolle spielen werden.Wir haben bisher gute Erfahrungen mit diesen Methoden gemacht. So behandeln wir einige Patient:innen – typischerweise mit hoher Tumormutationslast –, die sich seit mehreren Jahren in Remission befinden, erfolgreich mit CPI.
Ob unsere Beobachtungen einer randomisierten Studie standhalten, bleibt natürlich offen, solange die CUPISCO-Studiendaten noch nicht ausgewertet sind. Bis jetzt beruhen die Erkenntnisse vor allem auf Einzelfällen. Für die Immuntherapien existieren immerhin einige kleine Studien, die zeigen, dass in der Zweit- und Drittlinie insbesondere CUP-Patient:innen mit hoher Tumormutationslast von einer Checkpoint-Inhibition profitieren.
Nach der Sequenzierung von mehr als 600 Patient:innen im Rahmen von CUPISCO werden wir das CUP-Syndrom hoffentlich bald pathogenetisch besser verstehen. Auf dieser Basis könnten neue Behandlungsansätze entstehen.
Interview: Lara Sommer