Vorhofflimmern Unterwegs im Vorhof
 Vor allem bei VHF-Patienten mit Herzinsuffizienz und eingeschränkter Pumpfunktion ist die Katheterablation die Therapie der Wahl.
© magicmine – stock.adobe.com
Vor allem bei VHF-Patienten mit Herzinsuffizienz und eingeschränkter Pumpfunktion ist die Katheterablation die Therapie der Wahl.
© magicmine – stock.adobe.com
In den nächsten 20 Jahren wird sich die Prävalenz des Vorhofflimmerns (VHF) von derzeit 2–4 % aufgrund des demografischen Wandels vermutlich verdoppeln. Im Zuge dessen wächst auch der gesellschaftliche und gesundheitsökonomische Stellenwert von Diagnostik und Therapie der Rhythmusstörung, schreiben Dr. Leonard Bergau vom Herzzentrum Göttingen und Prof. Dr. Philipp Sommer vom Herz- und Diabeteszentrum Nordhein-Westfalen in Bad Oeynhausen. Aktuell fußt die Therapie auf drei Säulen:
- Schlaganfallprophylaxe (s. Kasten)
- Einstellung kardiovaskulärer Risikofaktoren
- Symptomkontrolle durch Sinusrhythmuserhalt bzw. Frequenzkontrolle
Rhythmus- und Frequenzkontrolle wurden lange als gleichwertige Optionen betrachtet. Doch nicht zuletzt die EAST-AFNET-4-Studie trug dazu bei, dass sich diese Sichtweise inzwischen ändert. In der randomisierten Untersuchung schnitt die frühe Rhythmuskontrolle (Antiarrhythmika oder Katheterablation) bei kürzlich diagnostiziertem VHF besser ab. Im Vergleich zur Frequenzkontrolle hatten die so behandelten Teilnehmer ein signifikant geringeres Risiko für kardiovaskulären Tod, Schlaganfall oder Hospitalisierung wegen kardialer Dekompensation bzw. akutem Koronarsyndrom.
Vor allem bei VHF-Patienten mit Herzinsuffizienz und eingeschränkter Pumpfunktion ist die Katheterablation die Therapie der Wahl, betonen die Autoren. Eine erfolgreiche Intervention reduziert u.a. das Remodeling im Ventrikelmyokard.
Darüber hinaus beeinflusst sie die Prognose: Gegenüber der medikamentösen Behandlung (Frequenz- oder Rhythmuskontrolle) gehen Todesfälle und herzinsuffizienzbedingte Klinikeinweisungen deutlich zurück.
Da sich ein VHF in 94 % der Fälle auf eine spontane elektrische Aktivität aus den Pulmonalvenen zurückführen lässt, wird standardmäßig im Bereich der Venenmündungen verödet (Pulmonalvenenisolation). Nach sechs bis acht Wochen weiß man, ob der Kathetereingriff nachhaltig Erfolg verspricht. Innerhalb dieser Frühphase (Blanking-Periode) werden Rezidive konservativ mittels elektrischer und/oder medikamentöser Kardioversion adressiert.
Antikoagulation teils unabhängig vom Risikoscore
Ob bei VHF-Patienten eine orale Antikoagulation notwendig ist, richtet sich i.d.R. nach dem CHA2DS2-VASc-Score. Er greift auch dann, wenn nach einer etwaigen Ablation langfristig Rhythmusstabilität besteht. In bestimmten Situationen sollte ein Gerinnungshemmer allerdings unabhängig vom Risikorechner verordnet werden:
- nach medikamentöser oder elektrischer Kardioversion (für vier Wochen)
- nach Katheterablation (für acht Wochen, Einnahme ab zwei Wochen vor dem Eingriff empfohlen, um Verträglichkeit und potenzielle Nebenwirkungen zu klären)
- bei bestehender mittel- bis hochgradiger Mitralklappenstenose und VHF (Vitamin-K-Antagonist indiziert)
Viele Ablationskandidaten nehmen dauerhaft ein orales Antikoagulans ein. Absetzen muss man das Präparat meist nicht. Stattdessen lautet die Empfehlung, NOAK oder Vitamin-K-Antagonisten (Ziel-INR am Tag des Eingriffs: 2,0–2,5) unverändert fortzuführen. Falls die morgendliche Gabe am Tag der Prozedur pausiert wird, sollte die Medikation postinterventionell schnellstmöglich wieder angesetzt werden – spätestens am Abend.
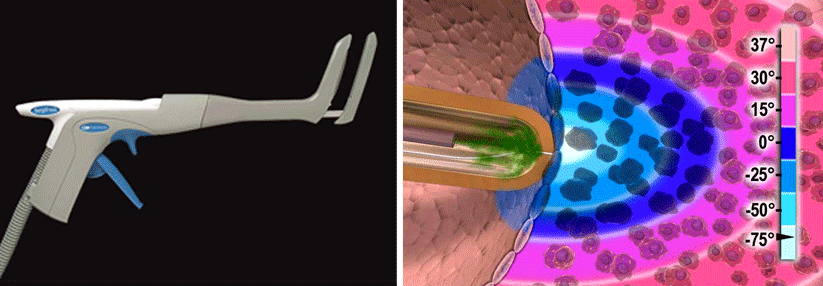
Elektroporation schont umliegende Strukturen
Ein Heparin-Bridging gilt als obsolet, betonen die Experten. Zur Pulmonalvenenisolation stehen im Alltag drei Techniken zur Verfügung.
Am weitesten verbreitet ist die Radiofrequenzablation. Dabei sorgt ein hochfrequenter Wechselstrom dafür, dass sich die Metallspitze des Katheters erhitzt. An den Verödungspunkten entlang der Isolationslinie bilden sich Nekrosen im Zielgewebe. Dieses Verfahren eignet sich wegen des flexibel einsetzbaren Katheters besonders für komplexe Prozeduren wie Rezidiveingriffe oder bei begleitendem Vorhofflattern.
Ebenfalls thermisch wirkt die Kryoablation. Während der Behandlung verschließt ein Ballonkatheter selektiv das Ostium der jeweiligen Pulmonalvene. Häufig genügt ein einziger Kälteimpuls, um ein Gefäß elektrisch zu isolieren. Diese Technik kommt vor allem für Patienten mit paroxysmalem VHF infrage. Die Erfolgsrate lässt sich mit der der radiofrequenzbasierten Therapie vergleichen.
Die jüngste und daher noch nicht so oft eingesetzte Methode nennt sich Elektroporation oder pulsed-field ablation. Hierbei schädigen wiederholte hochenergetische elektrische Impulse die Zellwand der Myozyten irreversibel, umliegende Strukturen bleiben verschont. Obwohl dieses nicht-thermische Verfahren als gewebespezifisch gilt, ist es nicht nebenwirkungsfrei. Wird z.B. in anatomischer Nähe zu den Koronarien verödet, kann es dort zu passageren Spasmen kommen. Die prophylaktische i.v. Gabe von Nitroglyzerin beugt dem aber effektiv vor.
Typische Komplikationen der Katheterablation (jährliche Inzidenz)
- Leistenkomplikationen: 1,31 %
- Perikarderguss/Tamponade: 0,78 %
- Schlaganfall/transitorische ischämische Attacke: 0,17 %
- permanente Läsion des N. phrenicus: 0,08 %
- atrioösophageale Fistel: 0,04 %
Bei der Radiofrequenz- und Kryoablation kann die thermische Mitreaktion in benachbarten Strukturen Probleme bereiten. Eine schwerwiegende Komplikation ist die atrioösophageale Fistel, die durch eine interventionsbedingte Schädigung der Ösophagusschleimhaut entsteht. In der Folge drohen Sepsis und Luftembolien bis hin zum Tod. Bei unklarem Fieber und einer Verschlechterung des Allgemeinzustands innerhalb der ersten sechs Wochen nach dem Eingriff sollte man an die Fistel als mögliche Ursache denken. Insgesamt treten Komplikationen aber selten auf, so die Autoren (s. Kasten). Schließlich zähle die Katheterablation heutzutage zu den Routineeingriffen in der klinischen Elektrophysiologie.
Quelle: Bergau L, Sommer P. Innere Medizin 2024; 65: 29-37; DOI: 10.1007/s00108-023-01636-5