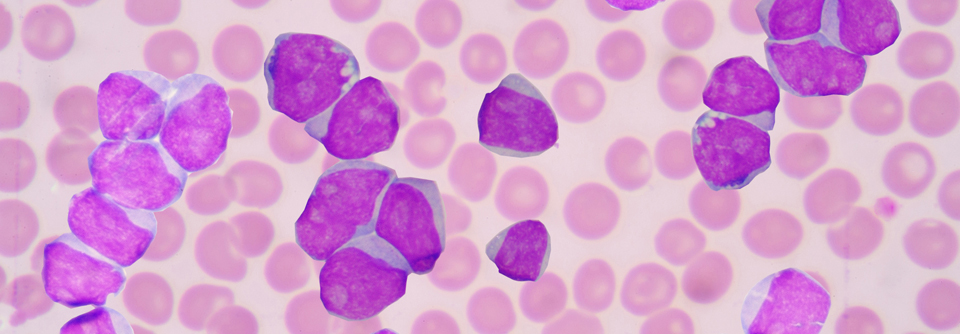
Akute Myeloische Leukämie Verbesserte transgene T-Zell-Rezeptor-Therapien und indirekte CAR-T-Zellen zukunftsweisend
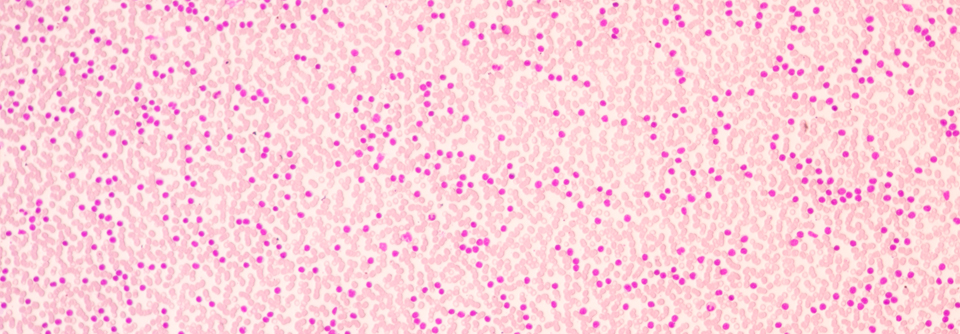 Die Erfolge, die bisher bei der pädiatrischen AML erreicht wurden, basieren u.a. auf einer sinnvollen Therapieintensivierung.
© iStock/toeytoey2530
Die Erfolge, die bisher bei der pädiatrischen AML erreicht wurden, basieren u.a. auf einer sinnvollen Therapieintensivierung.
© iStock/toeytoey2530
Die Erfolge, die bisher bei der pädiatrischen AML erreicht wurden, basieren u.a. auf einer sinnvollen Therapieintensivierung, auf der Verbesserung der supportiven Behandlung sowie auf Fortschritten in der hämatopoetischen Stammzelltransplantation. Dennoch bräuchte es neue Strategien, um die Prognose der Erkrankten weiter zu verbessern, konstatierte Prof. Dr. Patrick Schlegel von der Universität Sydney. Dies könne beispielsweise mit verbesserten transgenen T-Zell-Rezeptor(TCR)-Therapien sowie mit indirekten CAR-T-Technologien erreicht werden.
Die transgene TCR-Behandlung richte sich dabei gegen überexprimierte Zielstrukturen wie WT1. Individuelle Targets seien erstrebenswert, diese waren aber bisher nur wenig effektiv. Herausforderungen umfassen u.a. die Zielantigen-Dichte auf den Leukämiezellen, die Persistenz sowie eine verringerte Wirksamkeit. Um die Expression des transgenen TCR pro T-Zelle zu erhöhen, eigne sich z.B. der Knock-out der nativen TCR alpha- und beta-Kette. Außerdem könne man damit den Anteil an für den transgenen TCR positiven Zellen erhöhen. Damit ließe sich die Effektor-Funktion der transgenen T-Zelle verbessern.
Mehr als ein Target bei AML notwendig
Ein Problem sei die Suche nach dem perfekten Antigen, so der Referent weiter – denn dieses würde schlichtweg nicht existieren, da auch gesunde Zellen die Zielstruktur exprimieren und die Expressionslevel variieren. Zudem kann es zu einem Verlust des Antigens kommen. In heterogenen Krebsarten wie der AML sei die Adressierung von mehr als einem Target notwendig, damit CAR-Ts alle Tumorzellen erkennen.
Die CAR-T-Zell-Therapie bei AML-Patient:innen wird außerdem durch On-Target-Off-Tumor-Toxizitäten limitiert. Durch eine eingeschränkte Persistenz könne man dies teilweise umgehen, erläuterte Prof. Schlegel. Die CAR-Ts könnten z.B. vor einer allogenen hämatopoetischen Stammzelltransplantation (HSCT) zum Einsatz kommen, um eine komplette Remission zu erzielen, und anschließend durch die Konditionierung vor der HSCT eliminiert werden.
Um Tumorantigen-Heterogenität und Sicherheit gleichzeitig zu adressieren, eigneten sich indirekte CAR-T-Zell-Technologien. Sie beinhalten einen Linker, der die CAR-exprimierende Zelle mit ihrem Ziel verbindet. Das biete u.a. den Vorteil des transienten und universellen Einsatzes – Letzterer ist möglich, da der Linker auf beliebige Antigene angepasst werden kann. Erste Ergebnisse deuten darauf hin, dass es möglich ist, mit indirekten Technologien bei der AML komplette Remissionen zu erzielen. Zukünftig könnten verschiedene Linker kombiniert werden, um gleichzeitig unterschiedliche Strukturen zu erkennen und eine Immune Escape zu verhindern. Kluge Antigen-Kombinationen würden zwar zu denselben Toxizitäten führen, hätten aber einen stärkeren antileukämischen Effekt.
Letztendlich erlauben indirekte CAR-Strategien eine individualisierte AML-Therapie, schloss Prof. Schlegel. Gerade der Einsatz kombinierter Antigene könne die antileukämische Aktivität erhöhen und die hämatologische Erholung während der Infusionspausen vereinfachen.
Quelle: Schlegel P. 48th EMBT Annual Meeting; E2-04
Kongressbericht: 48th EMBT Annual Meeting