Auf Herz und Nieren prüfen
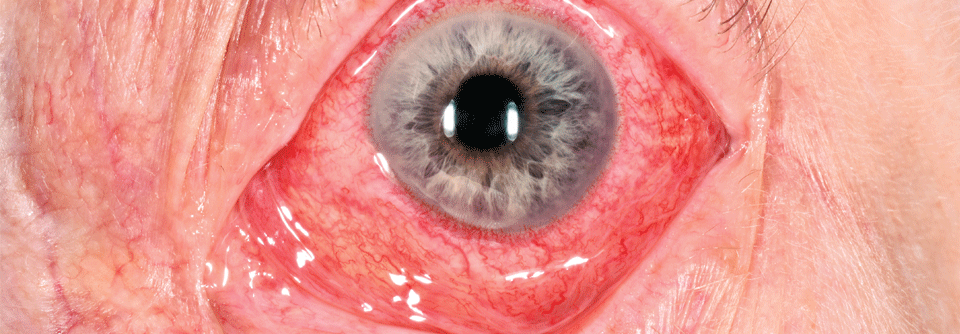 Neben Infektionen und Immuntherapie können u.a. Metastasen eine Uveitis auslösen. Es gilt daher, die Ursache abzuklären.
© Science Photo Library/Marazzi, Dr. P.
Neben Infektionen und Immuntherapie können u.a. Metastasen eine Uveitis auslösen. Es gilt daher, die Ursache abzuklären.
© Science Photo Library/Marazzi, Dr. P.
Immunvermittelte Nebenwirkungen (irAE) sind bei einer Behandlung mit Checkpoint-Inhibitoren (CPI) eher die Regel als die Ausnahme. Wann sie auftreten, lässt sich aber nur schwer vorhersagen – sogar ein Jahr nach Therapieende muss man noch mit ihnen rechnen. Und: Sie können praktisch jedes Organsystem betreffen. Den Umgang mit ihnen haben Professor Dr. Julie R. Brahmer von der Johns Hopkins Universität und andere Experten der Society for Immunotherapy of Cancer in einer Leitlinie zusammengefasst.
Hämatotoxizitäten
Auch wenn Hämatotoxizitäten bei Checkpoint-Inhibition mit insgesamt weniger als 1 % ungewöhnlich sind, gehen die Autoren darauf ein. Am häufigsten komme es zu Thrombozytopenien und hämolytischen Anämien. Etwa 43 % der Patienten, die wegen einer hämolytischen Anämie ihre Therapie mit CPI unterbrechen, erfahren nach Wiederaufnahme erneut hämatologische Nebenwirkungen. In den meisten Fällen sollen sich die Symptome nach 2–9 Wochen bessern, manchmal dauert es aber auch wesentlich länger. Zum Standard in der Behandlung gehört Prednisolon in der Tagesdosis von 1 mg/kg.
Bei Patienten mit hämolytischer Anämie, die darauf nicht ansprechen, sollte man zusätzlich intravenöse Immunglobuline geben. Dies empfehlen die Experten der US-amerikanischen Leitlinie auch bei schweren Thrombozytopenien. Ebenfalls könne man Rituximab erwägen.
Da Thrombozytopenien bei Krebspatienten allgemein, aber auch durch Vorbehandlungen und Autoimmunerkrankungen verbreitet vorkommen, ist es sinnvoll, vor Start der CPI die Plättchenzahl einmal zu bestimmen. So lässt sich bei einem Absinken unter diesen Basiswert ein therapiebedingter Mangel erkennen, was im Median um den 41. Therapietag geschehe.
Ermüdend oft
Endokrine Nebenwirkungen
Während viele irAEs abklingen, wenn man sie richtig behandelt oder die Checkpoint-Inhibition unterbricht, können gerade bei endokrinen Toxizitäten Organschäden zurückbleiben. Dies gilt besonders für die Schilddrüse, weshalb man bei Patienten unter CPI alle 4–6 Wochen die Hormone Thyreotropin (TSH), Trijodthyronin (T3) und Thyroxin (T4) bestimmen sollte. Selbst nach dem Ende der Behandlung empfiehlt sich noch ein- bis zweimal jährlich eine Kontrolle. Kommt es zu einer Dysfunktion, dann meist zu einer Hypothyreose. Sie trifft nach Angabe der Autoren zwischen 3 % der mit CTLA-4-Inhibitoren Behandelten und 15 % bei Kombination mit PD(-L)1-Hemmern. Die Schilddrüsenüberfunktion sei dagegen seltener und könne nach einer Weile auch in eine Unterfunktion übergehen. Ebenso regeneriere sich nach einer Thyreotoxikose die Schilddrüsenfunktion bei etwa neun von zehn Patienten nicht mehr vollständig. Zu einer L-Thyroxin-Substitution raten die Leitlinienautoren bereits bei einer latenten Hypothyreose, also bei anhaltend erhöhtem TSH und freiem T4 (fT4) im Normbereich ohne klinische Anzeichen einer Unterfunktion. Liege das fT4 zu niedrig und/oder manifestieren sich die typischen Symptome, solle man zusätzlich den basalen Kortisolspiegel am Morgen bestimmen, um eine eventuelle Nebenniereninsuffizienz abzuklären. Bei Anzeichen einer Hyperthyreose oder ansteigenden fT4-Werten empfiehlt sich die Gabe von β-Blockern, wobei man bei gleichzeitigem Asthma oder COPD kardioselektive Substanzen wie Atenolol oder Metoprolol wählen sollte. Zudem solle man eine Hypophysitis abklären und bei anhaltend zu hohem fT4 auch einen Morbus Basedow. Die Hypophysitis ist zwar selten, kann aber zu einer lebensbedrohlichen adrenergen Krise führen. Am häufigsten, so die Autoren, manifestiere sich die Entzündung der Hypophyse als sekundäre Nebenniereninsuffizienz, erkennbar an zu niedrigen Konzentrationen des adrenokortikotropen Hormons (ACTH). Daher sollte man dieses auch bei Patienten mit niedrigem Kortisolspiegel überprüfen, dabei aber beachten, dass die Tests auf beide Hormone durch Steroide wie Dexamethason beeinträchtigt werden. Typische Symptome umfassen Fatigue, Übelkeit und Erbrechen sowie Kopfschmerz, Libidoverlust oder erektile Dysfunktion. Da auch Metastasen eine Hypophysitis hervorrufen können, raten die Kollegen unbedingt auch zu einer spezifischen MRT des Gehirns. Bestätigt sich der Verdacht auf die irAE, sollte man die CPI unterbrechen und Hydrokortison in einer Tagesdosis von 10–12 mg/m² substituieren.Mehr Therapeutika, mehr Nebenwirkungen?
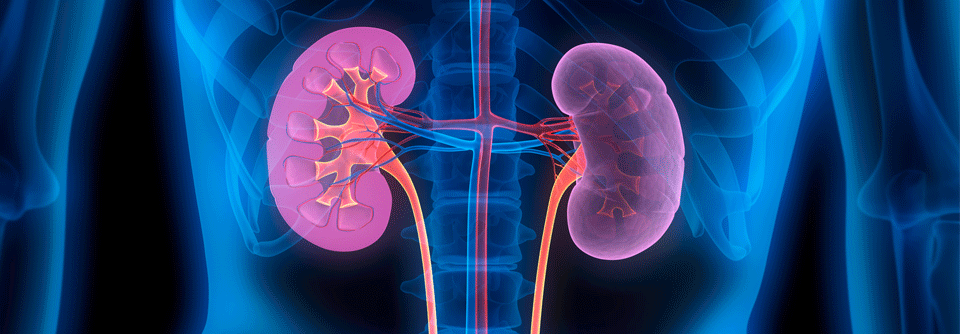
Renale Ereignisse
Nicht nur die Nebennieren, auch die Nieren selbst können von irAE betroffen sein. Tritt unter der Therapie ein akutes Nierenversagen (AKI) auf, liegt dem meist eine interstitielle Nephritis zugrunde. Ein Anstieg des Serumkreatinins, niedriggradige Proteinurie und mitunter eine sterile Pyurie sind typische Anzeichen dafür. Ein aktives Urinsediment oder eine ausgeprägte Hämaturie sprechen dagegen eher für glomeruläre Schädigungen. Sie entwickeln sich aber deutlich seltener. Findet man keine alternative Erklärung, soll man daher gemäß der Leitlinie von einer interstitiellen Nephritis ausgehen. Eine Biopsie, zu der die Autoren raten, kann mehr Klarheit bringen. Insgesamt komme es unter Checkpoint-Inhibition häufig zu einem AKI, wobei dies meist keine direkte Folge der verabreichten Substanzen sei, so Prof. Brahmer und Kollegen. Dies müsse man bei der Behandlung der Komplikation beachten. Die Rate der wirklich CPI-vermittelten AKI liegt ihren Angaben zufolge bei etwa 2 % unter Monotherapie und 5 % unter Kombination aus PD(-L)1- und CTLA-4-Hemmern. Vermutet man eine medikamentös bedingte Nierenschädigung, sollte man nicht nur den Checkpoint-Inhibitor absetzen, sondern auch andere Mittel, die eine interstitielle Nephritis verursachen können – beispielsweise NSAR, PPI oder bestimmte Antibiotika. Letztere muss man gegen eine Substanz aus einer anderen Wirkstoffklasse ersetzen. Um die interstitielle Nephritis in den Griff zu bekommen, sind Glukokortikoide das Mittel der Wahl. Auf sie spricht die Mehrzahl der Betroffenen an. Funktioniert das nicht, können Infliximab oder Mycophenolat-Mofetil wirksame Alternativen darstellen. Bei Patienten mit glomerulärer Ursache richtet sich die Behandlung gezielt auf die dabei jeweils vorliegende Erkrankung. Lässt sich die Nierenfunktionsstörung damit beheben, kann man die CPI im Anschluss wieder aufnehmen – zumindest, wenn das AKI das Stadium 1 nicht überschritten hatte. Bei schwereren Verläufen gehört der Patient in die Hände eines Nephrologen.Kardiologische Toxizitäten
Die Symptome von Myositis, Myokarditis und Myasthenia gravis überlappen sich. Deshalb gilt es immer, alle drei Erkrankungen abzuklären. Unter den kardiotoxischen Effekten ist vor allem die Myokarditis relevant. Sie scheint fast immer mit erhöhten Troponinwerten und auffälligem EKG einherzugehen, während die Hälfte der Betroffenen eine normale linksventrikuläre Ejektionsfraktion aufweist. Allein der Verdacht auf eine Herzmuskelentzündung sollte einen veranlassen, den Patienten ins Krankenhaus einzuweisen und einen Kardiologen mit einzubeziehen. Durch die immunvermittelte Myokarditis drohen weitere Komplikationen. Das Risiko für Arrhythmien, Herzstillstand, Herztod u.ä. lässt sich reduzieren, je früher die Betroffenen hoch dosierte Kortikosteroide erhalten. Ein Therapiebeginn innerhalb von 24 Stunden nach Klinikaufnahme senkte in einer retrospektiven Analyse die Rate der schwerwiegenden kardialen Ereignisse auf 7 % – gegenüber 85,1 %, wenn mehr als 72 Stunden vergingen. Patienten, die auf Kortikosteroide nicht ansprechen, können von Antithymoglobulin, Mycophenolat-Mofetil, Abatacept oder Alemtuzumab profitieren. Die Mortalität läge bei ihnen aber höher als bei den Steroid-Respondern, so die Autoren der Leitlinie. Von Infliximab sollte man dagegen eher absehen. Es erhöht das Risiko, an einer kardialen Ursache zu sterben, um das Zwölffache. Thromboembolien gehören zu den häufigsten Todesursachen bei Krebspatienten. Ob und in welchem Ausmaß auch ICI diese auslösen können, ist nicht bekannt. Treten Thromben auf, sollte man auf Steroide verzichten und den Betroffenen stattdessen antikoagulieren. Bei arteriellen Gerinnseln sollte man klären, ob eine Vaskulitis vorliegt. Ist dies nicht der Fall, kann die ICI-Therapie wieder aufgenommen werden.Ophthalmologische Toxizitäten
Eine Checkpoint-Blockade kann im wahrsten Sinne des Wortes ins Auge gehen. Gewöhnlich umfassen irAE dort Trockenheit und Uveitis. Sie plagen bis zu 24 % bzw. 6 % der Behandelten. Daneben seien aber weitere Komplikationen, die auch den Sehnerv betreffen können, berichtet worden, bemerken die Leitlinien-Autoren. Und sie warnen: Falsch eingeschätzt oder unbehandelt können diese die Sehkraft beeinträchtigen. Daher solle man die Betroffenen möglichst zum Augenarzt schicken – bei Komplikationen vom Grad 3 oder höher ohne Zeitverzug. Wenn nicht ohnehin schon aufgrund anderer irAE verordnet, empfehlen die Experten, Augenbeschwerden mit Kortikosteroiden zu behandeln. Dies solle jedoch unter Aufsicht durch den Ophthalmologen geschehen. Zudem müsse man bedenken, dass diese Mittel an sich Augeninfektionen verschlimmern oder auch die Diagnose sowie die Einschätzung des Schweregrads behindern können. Falls nichts dagegenspreche, dürfen auch frei erhältliche Präparate wie künstliche Tränen zur Linderung der Beschwerden genutzt werden.Quelle: Brahmer JR et al. J Immunother Cancer 2021; 9: e002435; DOI: 10.1136/jitc-2021-002435
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).