Cartoon Medizin und Markt
Behandlung der mittelschweren bis schweren aktiven Colitis ulcerosa
 Mirikizumab (Omvoh®) kann bei Colitis ulcerosa Patient:innen angwendet werden, wenn andere Therapieoptionen nicht angeschlagen haben.
© Tom – stock.adobe.com
Mirikizumab (Omvoh®) kann bei Colitis ulcerosa Patient:innen angwendet werden, wenn andere Therapieoptionen nicht angeschlagen haben.
© Tom – stock.adobe.com
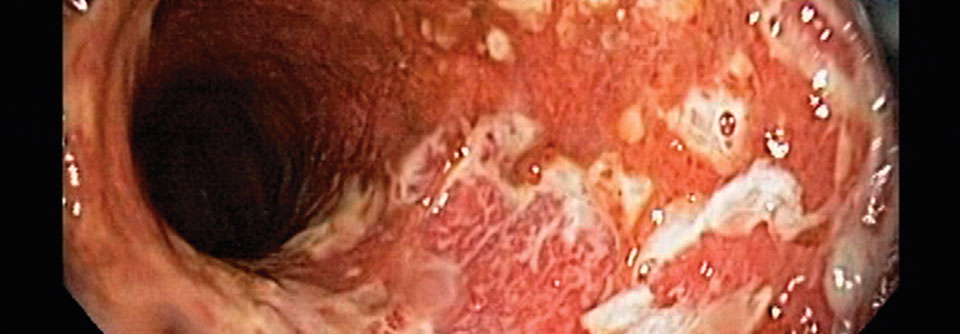
Wichtigste Ziele bei der Behandlung der Colitis ulcerosa (CU) sind laut der aktuellen S3-Leitlinie das rasche Erreichen einer klinischen Remission sowie die Aufrechterhaltung einer langfristigen steroidfreien klinischen und endoskopischen Remission.2 Für Patient:innen ist ein Symptom besonders belastend: die Bowel Urgency (imperativer Stuhldrang). Trotzdem wurde Bowel Urgency bisher noch nicht ausreichend als relevanter Endpunkt in klinischen Studien berücksichtigt. Über 80 % der Patient:innen leiden unter dem plötzlichen Drang, den Darm entleeren zu müssen. 3,4
Mirikizumab ist eine neue Therapieoption zur Behandlung der CUa , um nicht nur eine klassische klinische Remission, sondern auch um eine Remission der Bowel Urgency zu erreichen. Mirikizumab ist spezifisch gegen die IL-23p19-Untereinheit des Zytokins IL-23 gerichtet - einem Schlüsselzytokin in der Pathophysiologie der CU.5 Durch diese spezifische Blockade kann Mirikizumab auf das Entzündungsgeschehen wirken und die übermäßige Inflammation der Erkrankung kann inhibiert werden.1
LUCENT-Studienprogramm bestätigt starke und anhaltende Wirksamkeit, sowie steroidfreie klinische Remission6
Mirikizumab wurde in den randomisierten, doppelblinden, Placebo-kontrollierten Phase-III-Studien LUCENT-1 und -2 untersucht. Die einge-schlossenen Patient:innen mussten ein nicht adäquates Ansprechen, einen Wirkverlust oder eine Intoleranz gegen mindestens eine konventionelle Thera-pie oder ein Biologikum/Januskinase-Inhibitor (JAKi) aufweisen.1
Der primäre Endpunkt war das Erreichen der klinischen Remissionb in Woche 12 (LUCENT-1) bzw. in Woche 52 (LUCENT-2)c . Das Erreichen einer klini-schen Remissionb basierend auf dem modifizierten Mayo-Score war sowohl in Woche 12 als auch in Woche 52a signifikant gegenüber Placebo.6
Die Hälfte der Induktionsresponder:innend , die Mirikizumab 200 mg subkutan alle 4 Wochen erhielten, erreichte in Woche 52b die klinische Remission im Vergleich zu 25,1 % in der Placebo-Gruppe (p < 0,001).6
98 % der Mirikizumab-Patient:innend, die nach 52 Wochenb Therapie eine klinische Remission erreichten, waren seit mindestens 12 Wochen steroidfrei.6 Gerade die steroidfreie Remission ist eines der geforderten Ziele gemäß der S3-Leitlinie.2
Weitere relevante Endpunkte in LUCENT-1 umfassten u. a. das klinische An-sprechen, die endoskopische Remission sowie die symptomatische Remission in Woche 4 und Woche 12 sowie die histologisch-endoskopische Schleimhautverbesserung (HEMI)e . Die histologisch-endoskopische Schleimhautremission (HEMR)f wurde in LUCENT-2 untersucht. Es erreichten unter Omvoh® 200 mg s.c. in LUCENT-2 43,3 % der Patient:innend im Vergleich zu 21,8 % in der Placebo-Gruppe (p < 0,001) eine HEMR.6
Frühe Symptomkontrolle inkl. Bowel Urgency nach 2 Wochen8
Ein besonderes Augenmerk lag auf der Verbesserung der Bowel Urgency (imperativer Stuhldrang). Ein Symptom, an dem 85% der Colitis ulcerosa Patient:innen leiden und das erheblichen Einfluss auf die Lebensqualität hat.9 Es konnte gezeigt werden, dass eine signifikante Verbesserung der Stuhlfre-quenz, der rektale Blutungen und Bowel Urgency bereits nach 2 Wochen ein-traten.8
Überzeugende Verträglichkeit auf Placebo-Niveau6,7,10
In den beiden LUCENT-Studien verhielten sich beide Testgruppen bzgl. uner-wünschter Ereignisse ähnlich. Omvoh® war insgesamt gut verträglich mit ei-nem Nebenwirkungsprofil auf Placebo-Niveau.6,7,10
Einfache Anwendung
Alle 4 Wochen – zunächst intravenös (i.v.), dann subkutan (s.c.). In der Induk-tionsphase werden insgesamt 3 Infusionen mit Omvoh® 300 mg (i.v.), jeweils 1 Infusion, im Abstand von 4 Wochen verabreicht. In der Erhaltungsphase wer-den 200 mg Mirikizumab (s.c., 2 Injektionen je 100 mg) im Abstand von je 4 Wochen injiziert. Mirikizumab steht als Fertigpen und Fertigspritze zur Verfügung.1
Quelle: Pressemitteilung Lilly Deutschland GmbH
[a] Omvoh® ist zugelassen für die Behandlung von erwachsenen Patient:innen mit mittelschwerer bis schwerer aktiver Colitis ulcerosa, die auf eine konventionelle oder eine Biologika-Therapie unzureichend angesprochen haben, nicht mehr darauf ansprechen oder eine Unverträglichkeit zeigen.
[b] Klinische Remission wurde definiert als SF = 0, oder SF = 1 mit einer Abnahme von ≥ 1 Punkt gegenüber Baseline; RB = 0; ES = 0 oder 1 (ohne Schleimhautvulnerabilität)
[c] Voraussetzung für die Aufnahme der Patient:innen in LUCENT-2, sowohl für die Verum- als auch für die Placebogruppe, war ein klinisches Ansprechen zu Woche 12 in LUCENT-1 (Induktionsresponder:innen) unter Mirikizumab.
[d] bezogen auf die Patient:innen, die unter Omvoh® klinisches Ansprechen zu Woche 12 in LUCENT-1 erzielten.
[e] HEMI wurde definiert als das Erreichen von sowohl 1. histologische Verbesserung, definiert als 1. histologische Verbesserung, definiert als <5% der Krypten zeigen Infiltration von Neutrophilen, und Geboes-Sub-Scores von 0 für die Grade 4 (Zerstörung der Krypten) und 5 (Erosion oder Ulzeration) als auch 2. Endoskopische Verbesserung definiert als ES = 0 oder 1 (ohne Schleimhautvulnerabilität).
[f] HEMR wurde definiert als das Erreichen von sowohl 1. histologische Remission, definiert als Geboes-Sub-Scores von 0 für die Grade 2b (Neutrophile in der Lamina propria), 3 (Neutrophile im Epithel), 4 (Zerstörung der Krypten) und 5 (Erosion oder Ulzeration), als auch 2. Endoskopische Verbesserung definiert als ES = 0 oder 1 (ohne Schleimhautvulnerabilität).
[1] Aktuelle Fachinformation Omvoh®
[2] Kucharzik T, et al. Aktualisierte S3 Leitlinien Colitis ulcerosa (Version 6.1), verfügbar unter https://register.awmf.org/assets/guidelines/021-009l_S3_Colitis-ulcerosa_2023-03.pdf
[3] Nóbrega VG et al. Arq Gastroenterol 2018; 55: 290-292
[4] Petryszyn PW et al. Adv Clin Exp Med 2018; 27: 813-818
[5] Verstockt B et al. Nat Rev Gastroenterol Hepatol 2023: [epub ahead of print] doi.org/10.1038/s41575-023-00768-1
[6] Dubinsky MC al. [Presentation] Digestive Disease Week 24. Mai 2022; San Diego, USA
[7] Dubinsky MC et al. [Abstract] 867e, Digestive Disease Week 24. Mai 2022; San Diego, USA
[8] Danese S et al. J Can Assoc Gastroenterol 2023; 6(Suppl 1): 28–29
[9] Sninsky JA et al. Am J Gastroenterol 2022; 117(5): 769–776
[10] D’Haens G et al. J Crohns Colitis 2022; 16 (Suppl 1): OP26
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).