
Das Therapieziel lautet minimale Krankheitsaktivität
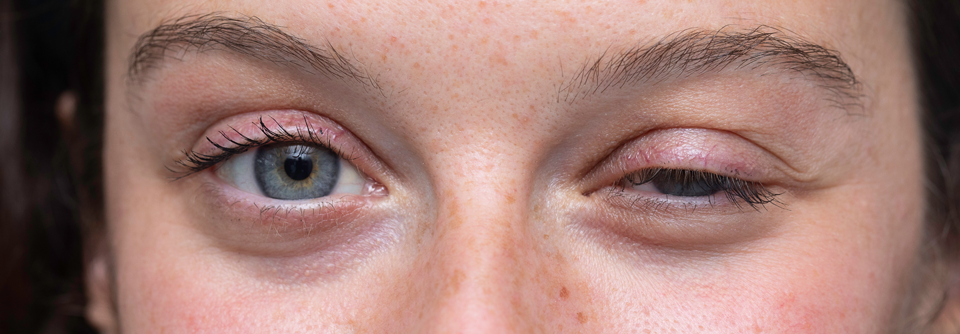 Diese Myastheniepatientin versucht vergeblich, ihr rechtes Auge zu öffnen.
© Alessandro Grandini‒ stock.adobe.com
Diese Myastheniepatientin versucht vergeblich, ihr rechtes Auge zu öffnen.
© Alessandro Grandini‒ stock.adobe.com
m 1900 starben praktisch alle Patienten mit Myasthenia gravis (MG) in der myasthenen Krise. Inzwischen liegt die Mortalität der MG dank Kortison und Immunsuppressiva unter 5 %, erinnerte Prof. Dr. Kristl Claeys, Universität Löwen. Therapieziel heute ist der Minimal Manifestation Status. Der Patient soll höchstens eine leichte Muskelschwäche zurückbehalten, aber keine MG-Symptome oder funktionellen Einschränkungen – dies alles bei allenfalls geringfügigen Nebenwirkungen.
Immuncheckpoint-Inhibition weckt die MG
Immer mehr onkologische Patienten erhalten eine Immuntherapie mit Checkpoint-Inhibitoren (CPI) gegen CTLA-4*, PD-1 oder PD-L1**. Infolge der T-Zellreaktivierung kann eine Myasthenia gravis als Nebenwirkung auftreten oder sich verschlechtern. Das geschieht selten (0,1 % bis 0,2 % unter PD-1-Inhibitoren), endet aber oft tödlich. Gewöhnlich tritt die MG im ersten CPI-Behandlungsmonat auf und verschlechtert sich meist rapide. Die Mortalität infolge von MG-Krisen oder begleitender Myokarditis liegt bei 25–30 %. AChR-positive Patienten scheinen besonders häufig betroffen zu sein, was aber keine Indikation zur Antikörpertestung vor CPI-Therapie bei Patienten ohne MG liefert.
Eine vorbestehende, gut kontrollierte MG stellt keine absolute Kontraindikation für eine Behandlung mit CPI dar, sollte aber Anlass zur engmaschigen Kontrolle der respiratorischen und bulbären Funktion geben. Bei MG-Patienten, die ohne Therapie in Remission sind, ist eine Wiederaufnahme der Behandlung sinnvoll. Entwickelt ein Patient unter CPI eine MG, wird eine rasche aggressive Therapie erforderlich (hoch dosierte Steroide, Plasmaaustausch, intravenöse Immunglobuline). Ob die CPI-Therapie zu beenden ist, richtet sich nach dem onkologischen Status.
* Cytotoxic T-Lymphocyte-Associated Antigen 4
** Programmed Cell Death Protein 1 bzw. dessen Ligand
AChE-Hemmer-Dosis an Symptome anpassen
Im ersten Schritt erhalten praktisch alle Patienten einen Acetylcholinesterasehemmer in einer den Symptomen angepassten Dosis, erinnerte Prof. Claeys. Werden damit die Ziele nicht erreicht, folgen Steroide und/oder Immunsuppressiva.
Die initiale Kombination mit einem Immunsuppressivum ist zu empfehlen, wenn
- aufgrund von Begleiterkrankungen ein hohes Risiko für Steroidnebenwirkungen besteht,
- unter Steroidgabe starke Nebenwirkungen auftreten,
- Steroide allein nicht ausreichen,
- die Steroiddosis nach Remission nicht reduziert werden kann, weil Symptome zurückkehren.
Befand sich ein Patient 6–24 Monate stabil in Remission, empfiehlt sich ein Steroidtapering. „Es kann sich über lange Zeit hinziehen, und manche Patienten brauchen langfristig eine niedrige Steroiddosis“, so Prof. Claeys. Auch Immunsuppressiva sollten, soweit möglich, langsam ausgeschlichen werden.
Wichtig ist, sich den Zeitrahmen klarzumachen, in dem die Therapien wirken. Bei Acetylcholinesterasehemmern handelt es sich um Stunden, bei Steroiden um Wochen, bei Immunsuppressiva und Thymektomie um Monate.
Die konkrete Strategie im Einzelfall richtet sich nach Symptomkonstellation und Antikörpernachweis.
Bei klinischem MG-Verdacht Antikörper messen
Bei etwa 90 % der MG-Patienten sind die Augen- und Gesichtsmuskeln betroffen, gefolgt von Oberarm- und Oberschenkelmuskulatur. Fast alle Kranken zeigen okuläre Symptome, und 10–20 % behalten sie trotz erfolgreicher Therapie zurück, erklärte Prof. Dr. Amelia Evoli, Universität Rom. Stärke und Ausdehnung der Muskelschwäche können variieren, atypische Formen kommen vor, etwa als MG des Schultergürtels.
Den Verdacht auf eine MG sollten ein bilateraler Muskelbefall, abnorme Ermüdbarkeit der Muskeln ohne relevante Atrophie bei erhaltener Sensorik wecken. Die Suche nach Autoantikörpern ist in solchen Fällen zwingend erforderlich. Bei 85 % der Patienten lassen sich Autoantikörper gegen Acetylcholin-Rezeptoren (AChR) im Radioimmun- oder zellbasierten Assay nachweisen, was als nahezu pathognomonisch gilt. Sehr viel seltener finden sich Antikörper gegen MuSK*oder LRP4**. Nur einer von 100 Patienten ist triple-seronegativ – dann muss die Elektrodiagnostik vorzugsweise per repetitiver Nervenstimulation den Verdacht sichern oder widerlegen, ebenso wenn die Immunsuppression nicht warten kann.
* muskelspezifische Tyrosinkinase
** LDL Receptor-related Protein-4
- Bei rein okulärer MG sollen Steroide oder ggf. Immunsuppressiva versucht werden, wenn die Symptome unter Acetylcholinesteraseinhibition nicht verschwinden und den Patienten funktionell einschränken. Lassen sich AChR-Antikörper nachweisen, sollte dem Patienten die Thymektomie angeboten werden, falls die medikamentöse Therapie nicht anschlägt.
- Bei generalisierter MG mit AChR-Antikörpernachweis kann die Thymektomie das klinische Ansprechen steigern, Steroidbedarf und Rezidivrisiko reduzieren. Sie ist deshalb früh im Verlauf zu erwägen, stellt allerdings keine Option für Patienten mit MuSK- oder LRP4-Antikörpern dar. Die Vorbehandlung mit i.v. Immunglobulinen oder Plasmaaustausch beschleunigt die postoperative Erholung.
- MuSK-positive Patienten sprechen meist schlecht auf AChE-Hemmer an und neigen verstärkt zu Nebenwirkungen. Steroide und Immunsuppressiva wirken bei ihnen meist gut, lassen sich aber oft nur schlecht tapern. Reagiert der Patient auf die initiale Immunsuppression nicht zufriedenstellend, ist Rituximab eine Option. Als erfolgversprechend, aber aufwendig gilt der Plasmaaustausch.
- Haben sich die Symptome unter Steroiden und mindestens zwei anderen Immunsuppressiva nicht gebessert oder sogar verschlechtert, ist von einer refraktären MG auszugehen. Dann bleiben noch die Langzeitbehandlung mit intravenösen Immunglobulinen, der Plasmaaustausch, Cyclophosphamid oder Rituximab und als Ultima Ratio bei schweren Symptomen der Antikomplement-Antikörper Eculizumab. Vor dessen Einsatz muss der Patient gegen Meningokokken geimpft sein.
Kongressbericht: 8th Congress of the European Academy of Neurology
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).

