Myasthenia gravis symptomatisch und immunsuppressiv therapieren
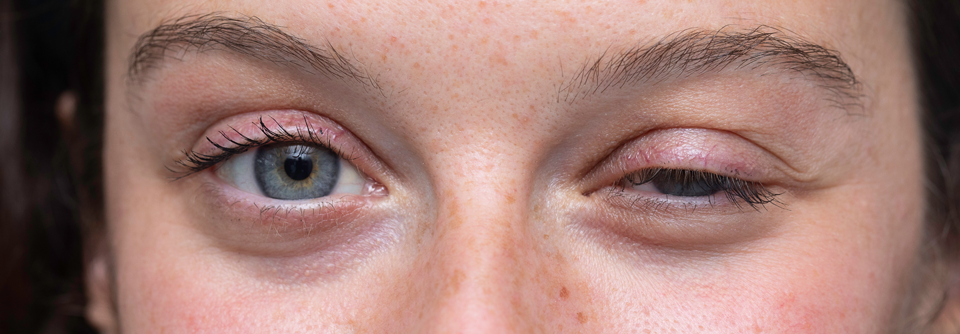
 Das linke Oberlid hängt deutlich mehr als das rechte: Die asymmetrische Ptosis ist typisch für die okuläre Beteiligung bei der MG.
© Stascheit F et al. internistische praxis 2020; 63: 1-18 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach
Das linke Oberlid hängt deutlich mehr als das rechte: Die asymmetrische Ptosis ist typisch für die okuläre Beteiligung bei der MG.
© Stascheit F et al. internistische praxis 2020; 63: 1-18 © Mediengruppe Oberfranken – Fachverlage GmbH & Co. KG, Kulmbach
Vor 120 Jahren kam die Diagnose Myasthenia gravis (MG) praktisch einem Todesurteil gleich. Heute liegt die Letalität unter 5 % und die Lebenserwartung in der normalen Spanne, schreiben Dr. Frauke Stascheit von der Klinik für Neurologie der Charité – Universitätsmedizin Berlin und Kollegen.
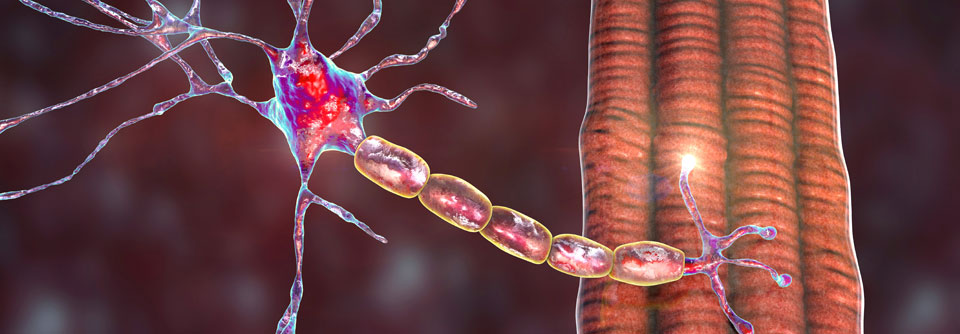
Die MG zählt mit einer Prävalenz von 150–250 Fällen pro 1 Million Einwohner zu den seltenen Erkrankungen, in Deutschland gibt es ca. 16 000 Betroffene. Wenngleich insgesamt selten, ist die MG doch die verbreitetste durch Antikörper vermittelte Autoimmunerkrankung der neuromuskulären Endplatte. Pathogenetisch liegen ihr sowohl genetische als auch Umweltfaktoren zugrunde.
Man unterscheidet eine…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.