Ein Potpourri aus Biomarkern soll helfen, die richtige Therapiewahl zu treffen
 Biomarker haben in der Onkologie einen vielfältigen Nutzen. Sie können bei der Risikobeurteilung, der Charakterisierung und schließlich auch bei der Wahl der Therapie helfen.
© smshoot – stock.adobe.com
Biomarker haben in der Onkologie einen vielfältigen Nutzen. Sie können bei der Risikobeurteilung, der Charakterisierung und schließlich auch bei der Wahl der Therapie helfen.
© smshoot – stock.adobe.com
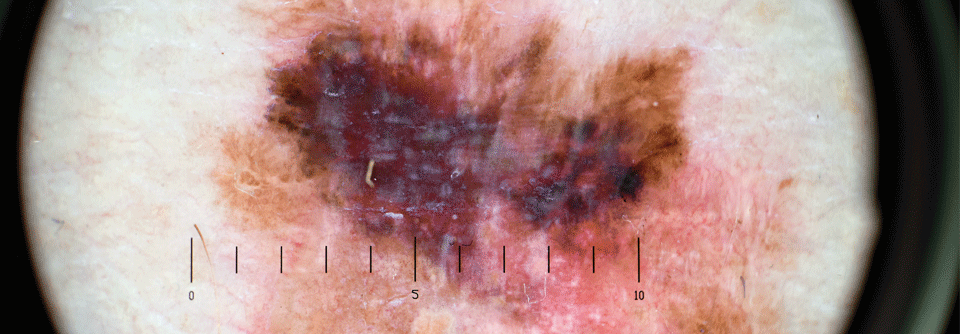
Der Nutzen von Biomarkern in der Onkologie ist vielfältig: Vor der Diagnose könnten sie beim Screening und bei der Risikobeurteilung helfen, im Rahmen der Diagnose dann dazu beitragen, den Tumor näher zu charakterisieren und im späteren Verlauf schließlich die Wahl weiterer Therapien erleichtern oder zum Monitoring auf Rezidive dienen. Insofern könnte man mit Biomarkern zukünftig vielleicht das Ziel erreichen, Melanome zu heilen. Nur: „Wir können sie noch nicht richtig anwenden“, gab Prof. Dr. Reinhard Dummer vom Universitätsspital Zürich zu bedenken. Derzeit befinde man sich noch in einem Lernprozess.
Ein Problem sei, dass Biomarker immer nur so gut seien, wie die Daten, die mit ihnen verknüpft sind. Und die besten Daten erhalte man aus klinischen Studien, sagte der Referent. Daher freute er sich, dass Medikamenten-Studien wie COMBI-AD oder COLUMBUS bereits von Beginn an auch die genetischen und transkriptomischen Veränderungen im Tumorgewebe und seiner Umgebung berücksichtigten.
Die Ergebnisse beider Studien hatten dargestellt, dass eine Kombination aus BRAF- und MEK-Inhibitor bei fortgeschrittenen Melanomen mit BRAF-Mutation das progressionsfreie und das Gesamtüberleben gegenüber Placebo bzw. einem BRAF-Inhibitor allein verbesserten. Anhand der zusätzlichen molekularen Marker ließ sich jedoch feststellen, dass nicht alle Betroffenen gleichermaßen profitierten, hob der Referent hervor.
Ein Plus: Hoher IFN-g-Spiegel, aber wenig Mutationen
Eine besondere Rolle spielten offenbar die Anzahl der tumorspezifischen Mutationen und die T-Zell-Inflammation, wie Prof. Dummer ausführte. So hatten Teilnehmende mit hoher Mutationslast und hohen Interferon-g-Spiegeln unter einer adjuvanten Therapie mit Dabrafenib plus Trametinib zwar die beste Prognose mit dem besten Outcome – das allerdings auch unter Placebo, sodass der Effekt nicht signifikant ausfiel. Diese Merkmalskonstellation wies also auf eine insgesamt vorteilhafte Prognose hin. Den größten Benefit durch die Kombinationstherapie hatten dagegen diejenigen, die bei hohen IFN-g-Spiegeln nur wenige Mutationen aufwiesen. In dieser Patient:innengruppe senkte die Kombination das Risiko für Rückfälle oder Versterben gegenüber dem Placebo um 69 %.
War es umgekehrt – viele Mutationen und wenig IFN-g – profitierten die Teilnehmenden auf den ersten Blick kaum. „Aber: Da steckt noch mehr dahinter“, mahnte Prof. Dummer. Denn solange die Betroffenen die Kombination erhielten, traten auch bei ihnen nur selten Rückfälle auf. Erst mit dem Ende der Therapie nach zwölf Monaten nahmen die Rezidive im Verumarm rasant zu. Für den Experten ein deutliches Beispiel für den Zusammenhang zwischen Therapie und Immunsystem.
Ähnliche Beobachtungen hatten Wissenschaftler:innen auch beim Vergleich von Encorafenib plus Binimetinib gegenüber Vemurafenib gemacht. Hier zeigte sich ein größerer Nutzen durch die Kombination für Patient:innen mit hoher Mutationslast, hoher PD-L1- und hoher IFN-g-Genexpression. Nur einen geringen Behandlungseffekt gab es zudem bei Personen, die viel ErbB2 exprimierten oder Mutationen im PI3KCA-Signalweg aufwiesen – also Molekülen, die in der Tumorumgebung oder für Resistenzen relevant sind.
Doch das spiegelt nur einen Teil der Komplexität wider. Man müsse alle Interaktionen verstehen, die im Tumor ablaufen, betonte Prof. Dummer. „Dazu braucht man noch weitere Marker als nur ein Genexpressionsmuster oder ein Molekül. Da ist ein Netzwerk von unterschiedlichen Untersuchungen notwendig.“
0,0002 % der Rohdaten fließen in Therapieempfehlung
Wie das aussehen könnte, erforschen er und weitere Kolleg:innen in der Schweiz genauer. Im sogenannten Tumor-Profiler-Projekt, kurz TuPro, haben sie die Einzelzellen aus 126 Melanomen mit allen Techniken, die ihnen zum Generieren von Biomarkern zur Verfügung stehen, gleichzeitig untersucht. Darunter beispielsweise die digitale Pathologie, molekulare Analysen von DNA und RNA, Proteotyping oder auch Zelltypisierungen via Massenspektrometrie.
Vier Wochen, so Prof. Dummer, durfte es dauern, bis die Ergebnisse vorlagen. „Damit man noch etwas mit ihnen machen kann.“ Am Ende sollten sie nämlich in spezifische Therapieempfehlungen münden. In TuPro hat das funktioniert. Allerdings mussten die Forschenden die erhaltene Flut an Daten erst einmal so aufbereiten, dass sie die relevanten Informationen verständlich extrahieren konnten. Nur 0,0002 % der Rohdaten fanden letztendlich den Weg in die abschließenden Zusammenfassungen, wie der Experte berichtete.
Die Behandlungsempfehlungen, die auf dieser Basis entstanden, entsprachen seinen Angaben nach meist den Standardoptionen wie Checkpoint-, BRAF- oder MEK-Inhibitoren. Manchmal seien auch nicht umsetzbare Ansätze vorgeschlagen worden. Wenn möglich, habe man aber versucht, die Empfehlungen zu befolgen, wenn die Patient:innen schon mehr als zwei Therapien hinter sich gehabt hätten.
Gliazellen mit Merkmalen von Makrophagen
Interessant waren für das Team auch die Zellprofile der heterogenen Melanome, ergänzte der Vortragende. Anhand der Immunzellen, die sich im Tumorgewebe befanden, konnten sie fünf Immunphänotypen unterscheiden. So zeichneten sich Lymphknotenmetastasen durch besonders viele B-Zellen und Bystander-T-Zellen aus. Ausschließlich im Gehirn fanden die Forscher:innen Läsionen mit tumorassoziierten Makrophagen, die sich laut Prof. Dummer komplett von Makrophagen in anderen Geweben unterschieden. Hierbei handele es sich um eine Art von Gliazellen, die Merkmale von Makrophagen aufwiesen.
Auf Basis der Tumorzellen konnten die Wissenschaftlerinnen und Wissenschaftler acht zelluläre Phänotypen ausmachen, die unterschiedlich in den Läsionen verteilt waren, sodass sich sechs Patient:innengruppen bilden ließen. Auffällig: Bestimmte Gruppen sprachen offenbar besonders gut auf eine Kombination aus Dexamethason, Ixazomib und Lenalidomid an oder auch auf Binimetinib plus Neocuproin – eine experimentelle Substanz, die speziell MEK-Inhibitor-resistente Zellen treffen soll.
Klar ist, dass die 126 Proben noch nicht genügen, um detailliertere Aussagen zu treffen und das heterogene Ganze zu verstehen. Sie gäben aber schon einmal ein erstes Bild, resümierte Prof. Dummer.
Quelle:
Dummer R et al. 19th EADO Congress; Keynote Lecture „Predictive biomarkers in melanoma“
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).