Infektion rascher erkennen
 Die Therapie von Mykobakterien sollte immer
in einem spezialisierten Zentrum eingeleitet werden.
© iStock/toeytoey2530
Die Therapie von Mykobakterien sollte immer
in einem spezialisierten Zentrum eingeleitet werden.
© iStock/toeytoey2530
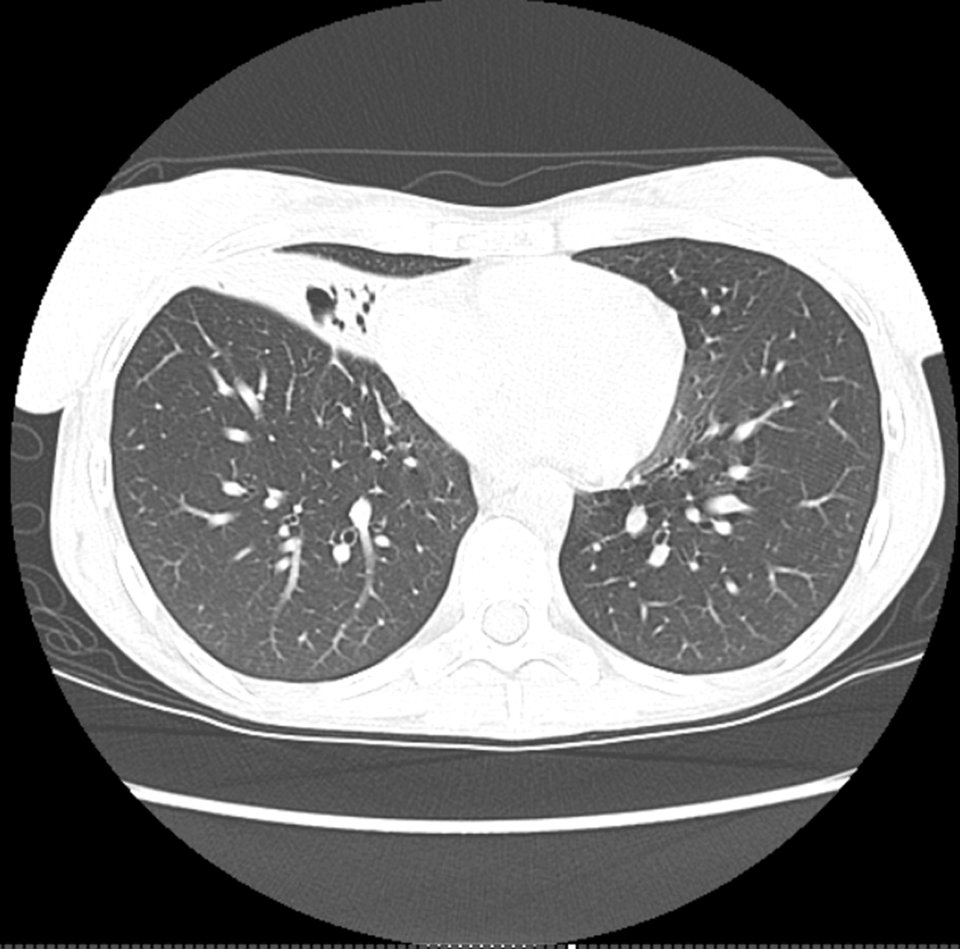
Man unterteilt nicht-tuberkulöse Mykobakterien (NTM) nach ihrer Wachstumsgeschwindigkeit in Kulturen in zwei Kategorien: langsam wachsende (bis zu zwölf Wochen) und schnell wachsende (innerhalb von sieben Tagen). Die genaue Identifizierung der Spezies hat Bedeutung, weil sie unterschiedliche Krankheitsbilder auslösen, schreiben Dr. Kartik Kumar vom National Heart and Lung Institute und Prof. Dr. Michael Loebinger vom Royal Brompton Hospital, beide in London. Am häufigsten isoliert wurden nach einer Erhebung über sechs Kontinente Mycobacterium avium complex (MAC), gefolgt von M. gordonae, M. xenopi, M. fortuitum, M. abscessus complex (MABC) und M. kansasii. Dabei kam MAC im nördlichen Europa häufiger vor als im südlichen. Für M. xenopi verhielt es sich umgekehrt.
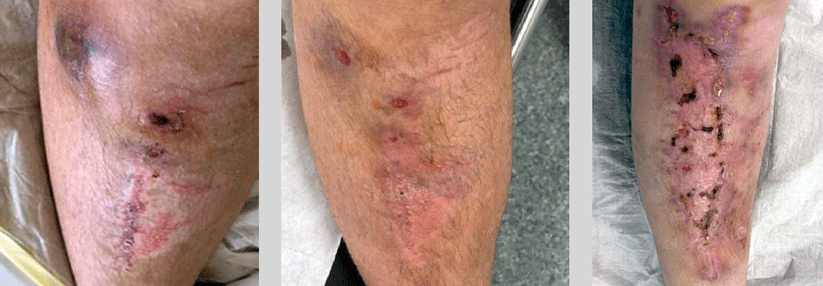
Das Syndrom der Lady Windermere
- Bronchiektasen
- COPD
- interstitielle Lungenerkrankungen
- genetische Erkrankungen (zystische Fibrose, Alpha-1-Antitrypsinmangel)
- erworbene Immundefekte
- Behandlung mit Immunsuppressiva
| NTM-Spezies nach Wachstumsgeschwindigkeit unterteilen | |
|---|---|
| langsam wachsend | schnell wachsend |
M. avium complex (MAC) mit u.a.:
| M. abscessus complex – mit u.a.:
|
| M. kansasii | M. chelonae |
| M. malmoense | M. fortuitum |
| M. xenopi | |
Quelle: Kumar K, Loebinger MR. CHEST 2021; DOI: 10.1016/j.chest.2021.10.003
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).