Langzeitrisiken nach Nierentransplantation
 Die Optimierung von Risikofaktoren (z.B. Blutdruck-, Cholesterin- und Diabeteseinstellung)
wird empfohlen.
© Christoph Burgstedt – stock.adobe.com
Die Optimierung von Risikofaktoren (z.B. Blutdruck-, Cholesterin- und Diabeteseinstellung)
wird empfohlen.
© Christoph Burgstedt – stock.adobe.com
Der medizinische Fortschritt durch intensive Forschung auf dem Gebiet der Organtransplantation hat die Erfolgsaussichten einer Nierentransplantation immer weiter verbessert. Heute funktionieren laut Bundeszentrale für gesundheitliche Aufklärung (BzgA) von 100 transplantierten Nieren ein Jahr nach der Operation noch etwa 89. Nach fünf Jahren arbeiten noch 75 der Spenderorgane. Es bleibt jedoch immerhin ein Viertel der Organempfänger, bei denen auch nach einer erfolgreichen NTX Probleme auftreten – Infektionen, kardiovaskuläre Komplikationen, Abstoßungsreaktionen. Das heißt, es lauern viele Risiken, die nachsorgende Behandlerinnen und Behandler, aber auch die Patientinnen und Patienten selbst im Blick behalten müssen. Denn es ist möglich vorzubeugen. Welche Komplikationen wie oft auftreten, was man dagegen tun kann und aktuelle Forschungsfelder, um bei der Prävention, Diagnostik und Therapie noch besser zu werden, standen im Mittelpunkt eines Symposiums im Rahmen der 15. Jahrestagung der DGfN in Berlin im Oktober 2023.
Infektionen
Die Genialität des menschlichen Immunsystems kann für Empfänger einer lebensrettenden Organspende zum Verhängnis werden. Um eine Rejektion zu verhindern, muss die Immunabwehr supprimiert werden, Infektionserreger haben leichtes Spiel. So stehen Medizinerinnen und Mediziner sowohl in der Frühphase als auch im Langzeitverlauf nach einer Nierentransplantation vor der Herausforderung, bei allen immunkompromitierten Patientinnen und Patienten die Balance zu finden zwischen dem Schutz vor Abstoßungsreaktionen und Infektionen, erklärte Prof. Dr. Claudia Sommerer, Heidelberg.
Infektionen sind eine der gefürchtetsten und gefährlichsten Komplikationen nach NTX, nicht nur, weil durch eine Infektion das Risiko für eine Transplantatabstoßung u.a. durch Anpassung der Immunsuppression steigt. Infektionen sind dritthäufigste Todesursache im ersten Jahr nach NTX und häufige Ursache für Tod mit funktionstüchtigem Transplantat, auch noch nach 2 − 5 Jahren [2]. Aktuelle Daten aus dem CTS-Register* zeigen, dass die Todesfälle assoziiert sind mit der Anzahl der HLAMismatches: Je mehr Mismatches, desto häufiger Infektionen und infektionsbedingter Tod.
Das Infektionsrisiko für spezifische Erreger korreliere zeitabhängig mit dem Net-Status der Immunsuppression. Einflussfaktoren auf das Risiko seien u. a. die Immunsuppression (Was? Wie viel? Wann?), Vorbehandlungen, Störung der mukokutanen Barriere, Neutropenie, Lymphopenie, Hypogammaglobulinämie, angeborene/erworbene Immundefekte, fortgeschrittenes Alter, metabolische Faktoren, Virusinfektionen [3].
Erregerspektrum
Nach Fishman et al. [3] sind es im ersten Monat vor allem nosokomiale Infektionen, bis zum sechsten Monat die Aktivierung latenter, z. B. opportunistischer wie Cytomegalievirus- (CMV) und BK-Polyomavirus (BKV)-Infektionen und im Verlauf ambulant erworbene Infektionen, die in der Nachsorge Probleme bereiten können. Die meisten Infektionen sind bakteriell bedingt (63 %, mehr als 19 % resistente Stämme, 50 % Enterococcen und 39 % Enterobacter).
Herpesviren und Aspergillosen sind auch im längerfristigen Verlauf relevant. Ebenso sind CMV-Infektionen sowohl initial als auch im Langzeitverlauf noch bedeutsam (14,3 % nach mehr als sechs Monaten [4]). Eine Prophylaxe könne das Auftreten wesentlich beeinflussen, insbesondere in der Hochrisikogruppe, betonte die Referentin. Besonderes Augenmerk gilt in der Transplantationsnachsorge älteren Patient:innen, oft mit Komorbiditäten, denn Alter und Zeitdauer der Hospitalisierung sind wichtige Risikofaktoren für Infektionen. Laut DZIF-Transplantkohorte sind Harnwegsinfektionen (42,4 %) insbesondere im Langzeitverlauf eine häufige Komplikation (25 %) [5].
Die häufigsten Erreger sind E. coli, Enterococcus und Klebsiella, erläuterte Frau Sommerer. Über 65-jährige TX-Empfänger sind es auch, die oft eine Pilzinfektion entwickeln [6]. Die Häufigkeit der Pilzinfektionen nehme zu. Je älter die Patientin oder der Patient ist, umso häufiger würden zudem rezidivierende Infektionen beobachtet. So waren in der DZIF-Transplantkohorte ein Viertel der über 65-jährigen Patienten betroffen [7]. Relevante Pathogene sind hier Enterococcus, E. coli, Klebsiellen, aber auch CMV [7].
Prävention
Wie Claudia Sommerer weiterhin ausführte, könne das Infektionsrisiko durch verschiedene Maßnahmen reduziert werden. Dazu gehören die Individualisierung der Immunsuppression, die Einhaltung der STIKO-Impfempfehlungen inkl. Zusatzmaßnahmen, ausreichende Prophylaxe und Monitoring- Strategien. Auch eine Infektiologische Visite bereits vor Transplantation kann hilfreich sein, um Risikopatienten herauszufiltern, die z. B. schon rezidivierende Atemwegsinfektionen hatten. Diese potenziellen Organempfänger sollten sorgfältig infektiologisch gecheckt und dann möglicherweise engmaschiger kontrolliert werden.
Kardiovaskuläre Komplikationen
Betrachtet man die Todesursachenstatistik in Deutschland, so sind laut statistischem Bundesamt chronische Nierenerkrankungen trotz hoher CKD-Prävalenz, insbesondere in der älteren Bevölkerungsgruppe (bis zu 30 % [8]), im Ranking der ersten 10 Ursachen nicht vertreten. Das, so hob Prof. Dr. Bernhard MW Schmidt, Hannover, hervor, sei hinsichtlich der nephrologischen Behandlungsqualität eine gute Nachricht. Die schlechte Nachricht ist, sie sterben trotzdem, und zwar an kardiovaskuläre Erkrankungen (25 % der Sterbefälle). KHK, akuter Myokardinfarkt und Herzinsuffizienz sind die Haupttodesursache sowohl bei Transplantierten als auch bei CKDbzw. Dialyse-Patientinnen und -Patienten [9]. Allerdings, so ergibt eine Metaanalyse aus 2022 [10], ist das Mortalitätsrisiko bei Transplantierten um ca. 55 % niedriger als bei Dialyse-Patientinnen und -Patienten. Ebenso schneiden Transplantierte bezüglich der linksventrikulären Hypertrophie besser ab als Diylse-Patientinnen und -Patienten[11] .
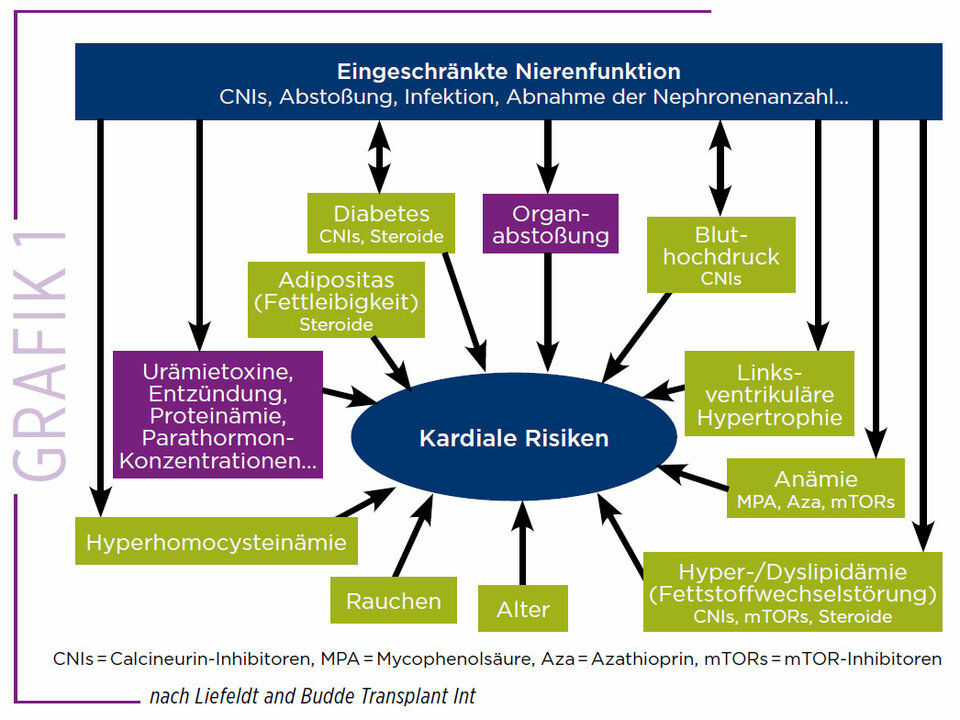
Die besseren Ergebnisse seien jedoch nicht automatisch auf Dauer garantiert. Denn die transplantierten Patient:innen sind trotz NTX nicht gesund, sie befinden sich im Hochrisikobereich, bestenfalls vergleichbar mit einem CKD-Stadium III, so Schmidt. Man müsse also das CV-Risiko im Zeitverlauf (Nierenversagen, Dialysestadium, NTX) auch bei den Organempfängern kontinuierlich im Auge behalten. Schmidt betonte, gerade bei Organempfängern gehören die kardiovaskulären Erkrankungen genauso zum Risikomanagement wie die Immunsuppression und Infektionen. Eine konsequente Therapie der Risikofaktoren kardiovaskulärer Erkrankungen (Grafik 1) sei bei dieser Klientel unverzichtbar.
Bluthochdruck
So haben z. B. 50 − 85 % aller Transplantierten, selbst im pädiatrischen Bereich, eine Hypertonie [12]. Risikofaktoren dafür sind die Organqualität, Abstoßungsreaktionen, das Alter, männliches Geschlecht, Adipositas und bei Kindern ein niedriges Lebensalter bei Tx [12], erläuterte Schmidt. Ein weiterer entscheidender Faktor für den Blutdruckanstieg seien die Calcineurininhibitoren (CNI) (CyA mehr als Tac).
Zur Behandlung werde empfohlen, mit einem Kalziumkanalblocker und der RAS-Blockade zu beginnen und die Diuretika- Therapie fortzusetzen. Zielwert sollte 130/80 mmHg sein, die KDIKO empfiehlt sogar möglichst darunter zu kommen [13]. Fettstoffwechselstörung Bei 50 − 60 % aller Transplantierten wird eine Dyslipidämie diagnostiziert. Risikofaktoren hierfür seien wiederum die Immunsuppressiva − vor allem die mTOR-Inhibitoren, aber auch Cyclosporin, am wenigsten Tacrolimus, Steroide, β-Blocker, auch bestimmte Antihypertensiva und Diuretika, sowie Adipositas und Proteinurie.
Bezüglich der Therapie zeigten Subanalysen der ALERT-Studie [14] in der Tendenz, dass Empfänger eines Spenderorgans von einer Statintherapie profitieren. Zum Zielwert des LDL-C gebe es leider kaum Daten. Da aber fast alle der Transplantierten eine eGFR unter 60 ml/min haben, sollte man sich an den kardiologischen Leitlinien [15] orientieren, die bei Patient:innen mit einer eGFR 30 − 60 ml/min einen Zielwert von 70 mg/dl empfehlen, im Hochrisikobereich sogar 55 mg/dl.
Diabetes mellitus
Zu den Patient:innen, die bereits vor der TX einen Diabetes haben, kommen nach Transplantation noch bis zu ca. 26 % hinzu, die innerhalb der ersten sechs Monate nach NTX einen Posttransplantationsdiabetes (PTDM) entwickeln, danach beträgt die Inzidenz 6 % pro Jahr. Bei allen Gruppen, sowohl denen, die keinen Diabetes hatten und jenen mit Pretransplant Diabetes sowie mit PTDM steigt das kardiovaskuläRisiko kontinuierlich an [16].
Als Risikofaktoren benannte Schmidt die CNI (Tac>CyA), Steroide, Adipositas, das Alter sowie eine Familienanamnese für Diabetes mellitus und mahnte an, den Posttransplantationsdiabetes genau so ernst zu nehmen wie den „normalen“ Diabetes und ebenso konsequent nach dem KDIGO/ ADA-Konsensus bzw. der KDIGO-Guideline [17] zu behandeln. Zu den SGLT2-Hemmern, aus Schmidts Sicht nicht nur für den Diabetes relevant, sondern für weitere Indikationen, gebe es bislang nur wenige Publikationen oder mit sehr kleinen Patientenzahlen. „Ich plädiere dafür, dass wir uns bei jedem einzelnen Nierentransplantierten aus guten Gründen aktiv dagegen entscheiden müssen, einen SGLT2-Hemmer zu verordnen.
Ansonsten sollte jeder Transplantierte, so wie die anderen Patient:innen mit entsprechender Indikation ihn bekommen sollte“, fasste Schmidt die in Fachkreisen noch etwas unsichere Einschätzung zum Einsatz dieser Präparate zusammen. Denn „zwar ist die Evidenz für die einzelnen Maßnahmen in unserem speziellen Kollektiv leider relativ gering. Dies darf aber nicht dazu führen, dass nierentransplantierte Patient:innen nicht adäquat behandelt werden. Wir haben sehr viel Evidenz für sehr wirksame kardioprotektive Therapien in ganz ähnlichen Kollektiven, bestes Beispiel sind die SGLT2-Inhibitoren. Diese Behandlungsmöglichkeiten sollten unseren Patient:innen nicht vorenthalten werden“, resümierte Prof. Schmidt.
Chronische Rejektion
Ein relevantes Problem im Langzeitverlauf nach NTX ist die Gefahr einer chronischen Abstoßung. Es sei eine recht häufige Komplikation mit schlechter Prognose und im Umgang mit transplantierten Patient:innen eine große Herausforderung, konstatierte PD Dr. Dr. Gunilla Einecke, Göttingen. Für das Management sind zwei Entitäten, die jeweils spezifische Herangehensweisen erfordern, zu unterscheiden: die chronische T-Zell-vermittelte Rejektion (T cell mediated rejection, TCMR) und die Antikörper-vermittelte Rejektion (Antibody-mediated rejection, ABMR). Zudem werden therapeutische Entscheidungen davon beeinflusst, wie in diesem Kontext „chronisch“ verstanden wird. Chronisch vs. akut oder, bezogen auf das Krankheitsstadium, chronisch im Gegensatz zu aktiv. Denn, so Dr. Einecke, eine Behandlung mache nur bei einem chronisch aktiven Verlauf Sinn (chronische ABMR ohne Nachweis von Aktivität gilt als sog. „ausgebrannte“ ABMR).
Humorale Rejektion
Die Diagnostik einer ABMR, häufig als chronisch aktive humorale Abstoßung auftretend, erfolgt derzeit anhand bestimmter Merkmale nach der sog. Banff-Klassifikation. Diese Klassifikation ist ein internationaler Standard histopathologischer Veränderungen einer Transplantatniere, mit dessen Hilfe die Bewertung von Abstoßungsreaktionen und anderen Transplantatpathologien möglich ist. Allerdings, so gab Frau Einecke zu bedenken, sei die Klassifikation in ihrer jetzigen Form insgesamt unbefriedigend, da die Heterogenität dieses Krankheitsbildes, die auf molekularer Ebene zu erkennen, jedoch anhand der Histologie nicht zu sehen ist, noch sehr unvollständig verstanden werde.
Wegen ihrer relativ geringen Aussagekraft habe die Klassifikation für das Management der Patient:innen und die Prognosestellung derzeit kaum Konsequenzen. Bleibt die Frage, welche Faktoren bei einem/r Patient:in entscheidend sind für die Prognose. Donorspezifische Antikörper (DAS) und molekulare ABMR-Aktivität sind es nicht, erklärte Dr. Einecke. Entscheidend für die Prognose sei vielmehr das Ausmaß der aktiven Parenchymschädigung [18], die z. B. in eine computerbasierte molekulare Subklassifikation mit einfließt. Diese Subklassifikation umfasse mehrere Parameter der humoralen Abstoßung. So können z. B. molekulare Subklassen die prognostische Aussagekraft deutlich verbessern [19], so dass die Zusammenführung der verschiedenen Komponenten in einer molekularen (Sub-)Klassifikation sicherlich ein Fortschritt sei.
Empfehlungen zur Behandlung sind im Konsensuspapier zur Therapie der ABMR (2020) [20] enthalten, jedoch aufgrund der dünnen Datenlage „relativ banal“: Optimierung der Erhaltungsimmunsuppression plus einiges, „was man in Erwägung ziehen kann (Immunglobuline und Rituximab, zwar ohne nachgewiesenen Nutzen in caABMR, was aber nicht heißt, dass es wegen fehlender Evidenz keinen Nutzen gibt).“ Zudem sollte man die Adhärenz der Organempfänger überprüfen und auch im Langzeitverlauf regelmäßig kontrollieren. Insgesamt gebe es keine Evidenz für spezifische therapeutische Interventionen, entsprechend sollten Nutzen und Risiko dessen, was man unternimmt, im Einzelfall sorgfältig abgewogen werden.
Des Weiteren werden supportive Maßnahmen, wie ein Wiederbeginn der Steroidgabe, Erhaltung des Tacrolimus-Zielspiegels bei über 5 ng/ml sowie die Optimierung von Risikofaktoren (kardiovaskuläres Risiko, Blutduck-, Cholesterin- und Diabeteseinstellung) empfohlen. Therapieziel sei, so Dr. Einecke abschließend, nach Möglichkeit die Stabilisierung der GFR, der Proteinurie und histologischer Schädigungen oder zumindest eine Verlangsamung der Verschlechterung und die Minimierung von Medikamententoxizität.
Chronisch aktive TCMR
Im Jahr 2017 wurde die Diagnose einer chronisch-aktiven TCMR (i-IFTA assoziiert mit Tubulitis = Kombination aus den beiden Läsionen entzündlicher Zellinfiltration [i-IFTA] und Tubulitis [t-IFTA]**) in die Klassifikation aufgenommen. Diese Diagnose ergibt sich aus drei Kriterien: 1. Inflammation in fibrotischen Arealen = i-IFTA-score ≥2 2. Tubulitis (t) score ≥2 und 3. Inflammation nicht nur in fibrotischen Arealen, sondern über das gesamte Transplantat = total inflammation (ti) ≥2 Die Rationale dafür war, erklärte Einecke, dass Inflammation in fibrotischen Arealen eine relevante Läsion und mit einer schlechten Prognose für das Transplantatüberleben verbunden ist [21].
Allerdings, so gibt sie einschränkend zu bedenken, sei Inflammation in vernarbten Arealen (i-IFTA) nicht spezifisch für Tx-Nieren, sondern ein unspezifisches Merkmal einer chronisch-aktiven Gewebsschädigung auch in nativen Nieren. Es können neben der Alloimmunität mehrere Faktoren, wie chronische Infektionen, schwere Atherosklerose, Medikamententoxizität oder auch rekurrente glomeruläre Erkrankungen zu i-IFTA beitragen.
Entsprechend kritisch und kontrovers wird die angenommene Kausalität TCMR vs. unspezifischer Marker einer chronischen Schädigung im Banff-Gremium diskutiert. Möglicherweise müsse mit neuen Daten diese Entität wieder aus der Klassifikation herausgenommen werden. Bzgl. der Therapie konnte bisher kaum ein Nutzen erhöhter Immunsuppression gezeigt werden und „man muss jeden Patienten/jede Patientin kritisch anschauen und überlegen, was zu tun ist, ggf. nach anderen Schädigungsmechanismen suchen.“
1. www.organspende-info.de/fileadmin/Organspende/05_Mediathek/Redaktionsbaukasten/Erfahrungsberichte/BZgA_RBK_Story_Elle.pdf
2. Opelz G, Doehler B. Am J Transpl 2012
3. Fishman JA et al. Am J Transpl 2017
4. Sommerer C et al. Poster 131 DGfN 2023
5. Schroeter I et al. Poster 120 DGfN 2023
6. Sommerer C. et al. Poster 130 DGfN 2023
7. Sommerer C. et al. Open Forum Infect 2022
8. Girndt et al. Dtsch Ärztebl Int 2016
9. Sarnak et al. Circulation 2003, Foley et al. AJKD 1998
10. Chaudry et al. BMJ 2022
11. Suglanto, Schmidt et al. Ped Nephrology 2020
12. Schmidt et al. ESH Mailand 2016
13. Kidney Int 2021
14. Holdaas et al. Lancet 2003
15. Eur Heart J 2020
16. Lim et al. Transplantation 2021
17. De Boer et al. Kidney Int + Diabetes Care 2022
18. Einecke G et al. Am J Transplant 2021
19. Reeve J et al. JCI Insight 2017
20. Schinstock c et al. Transplantation 2020
21. Mengel M et al. Am J Transplant 2009
Dieser Beitrag ist ursprünglich erschienen in: Nierenarzt/Nierenärztin 6/2023
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).