Diagnose Was sind die Merkmale der autosomal-dominanten tubulointerstitiellen Nierenerkrankung?
 Die Therapie der Wahl ist eine NTX, denn damit kommt die genetische Mutation nicht mehr zum Tragen.
© Robert Kneschke - stock.adobe.com
Die Therapie der Wahl ist eine NTX, denn damit kommt die genetische Mutation nicht mehr zum Tragen.
© Robert Kneschke - stock.adobe.com
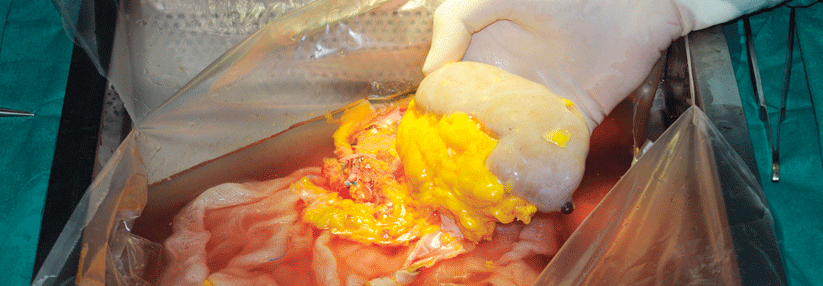
Die autosomal-dominante tubulointerstitielle Nierenerkrankung (ADTKD) zeichnet sich durch Mutationen in verschiedenen Genen aus. Es wird vermutet, dass die ADTKD eine der häufigsten monogenetischen Formen einer Nierenerkrankung darstellt. Ca. 5 % aller monogenetischen Ursachen einer chronisch funktionellen Nierenerkrankung sind auf eine ADTKD zurückzuführen (1).
Die häufigsten (ca. 50 %) aller ADTKD werden durch Mutationen im UMOD-Gen, das für Uromodulin codiert, oder am Gen MUC1, das für Mucin-1 codiert, verursacht (1). Des Weiteren kommen unter anderem Mutationen im Gen für den Transkriptionsfaktor 2, auch als hepatocyte nuclear factor 1-beta (Hepatozyten- nukleärer Faktor 1-beta, HNF1B)…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.