Von autoimmunem Stammzell-Pool initiiert
 Ob sich die Ergebnisse aus dem Mausmodell wohl auf den Menschen übertragen lassen?
© iStock/tiripero
Ob sich die Ergebnisse aus dem Mausmodell wohl auf den Menschen übertragen lassen?
© iStock/tiripero
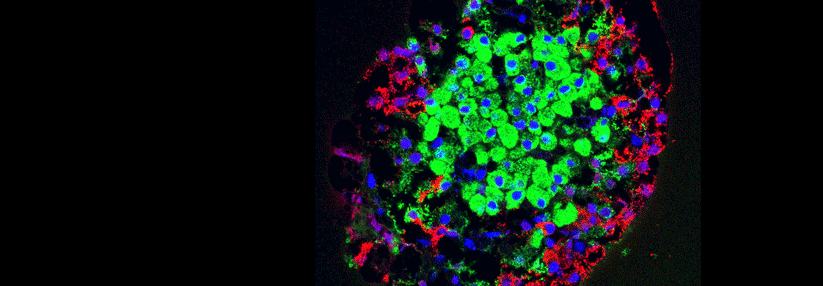
Anhand eines Mausmodells des nicht-adipösen Typ-1-Diabetes verfolgte ein Forschungsteam, wie sich Autoimmunzellen bilden und fortbestehen, ohne sich zu erschöpfen.1 Dafür konzentrierten sich die Wissenschaftler*innen um Dr. Sofia Vaccarino Gearty vom Memorial Sloan Kettering Cancer Center und Weill Cornell Medical College in New York auf CD8-T-Zellen, die sich gegen das Betazellprotein IGRP richten. Sowohl bei Mäusen als auch beim Menschen repräsentiert diese Subgruppe eine der hauptsächlichen pathogenen Zellpopulationen.
Aktive Autoimmunzellen im Pankreas sind nur kurzlebig
IGRP-spezifische CD8-T-Zellen fanden die Forschenden bereits bei fünf Wochen alten Modelltieren im pankreasdrainierenden Lymphknoten (pLN). Dort erfolgt das T-Zell-Priming, bevor die Zellen in die Bauchspeicheldrüse einwandern. Eine Expressionsanalyse der IGRP-positiven Zellen ergab, dass diese sich anhand hoher und niedriger Expression von TCF unterteilen lassen. Der Stammzell-Transkriptionsfaktor ist wichtig für T-Zell-Gedächtnis, Langlebigkeit und Selbsterneuerung.
Im pLN fünf Wochen alter Mäuse gehörten ca. 80 % der untersuchten Zellen der TCFhi- und 20 % der TCFlo-Subgruppe an. In der Bauchspeicheldrüse exprimierten alle IGRP-CD8-T-Zellen wenig TCF. Eine ähnliche Stammbaumgabelung in TCFhi/lo-Populationen fanden die Wissenschaftler*innen auch für CD8-T-Zellen, die sich gegen ein anderes Betazellepitop richteten.
Die weitere molekulare und funktionelle Charakterisierung der IGRP-gerichteten Zellen ergab eine Hierarchie mit drei groben Stufen:
- Stammzellen: pLN TCFhi
- Vorläuferzellen: pLN TCFlo
- differenzierte TCFlo-Zellen im Pankreas
Den Ergebnissen zufolge bildet die erste Subgruppe einen Stammzellpool im Lymphknoten. Daraus entspringen Vorläuferzellen, die in den Pankreas einwandern und dort weiter differenzieren. Im Gegensatz zu den langlebigen Stammzellen waren die TCFlo-Zellen kurzlebig und nicht in der Lage, die Autoimmunität aufrechtzuerhalten (s. Kasten).
Wann ist eine Stammzelle eine Stammzelle?
Weitere Forschung auch für Immunonkologie interessant
Ihnen zufolge wirft die Arbeit zudem zwei wichtige Fragen auf: Liegt anderen chronischen Autoimmunkrankheiten ebenfalls eine entsprechende Zellhierarchie zugrunde? Dann wären die Ergebnisse auch über den Typ-1-Diabetes hinaus von Bedeutung. Und weshalb wird in den beschriebenen Zellen kein Erschöpfungsprogramm eingeleitet? Das Verständnis darüber könnte z.B. für die Immunonkologie relevant werden. In dem Fall nicht, um beständige Immunantworten zu unterdrücken, sondern um sie zu ermöglichen.Quellen:
1. Gearty SV et al. Nature 2022; 602: 156-161; DOI: 10.1038/s41586-021-04248-x
2. Turner SJ, La Gruta NL. Nature 2022; 602: 35-36; DOI: 10.1038/d41586-021-03800-z
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).