Inseltransplantation bei Typ-1-Diabetes: Wer kommt infrage und wohin geht die Reise?
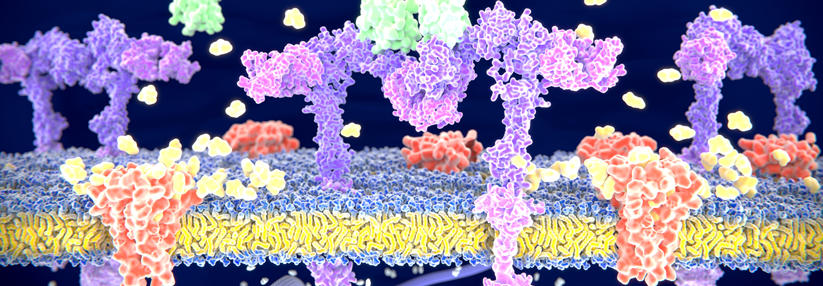
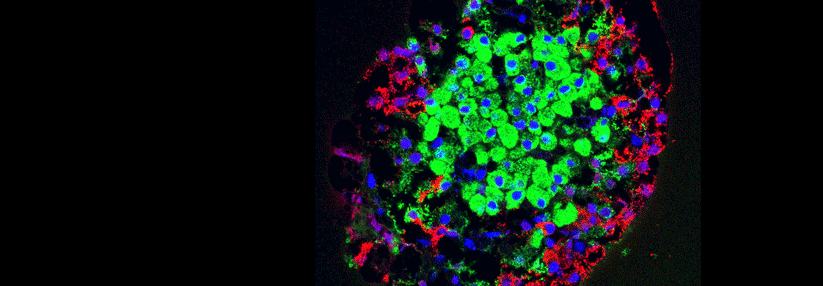 70 % einer Langerhansinsel bestehen aus Betazellen.
© wikimedia/Masur (CC BY 2.5)
70 % einer Langerhansinsel bestehen aus Betazellen.
© wikimedia/Masur (CC BY 2.5)
Obwohl wir immer mehr Technologien einsetzen, bleiben Krankheitskontrolle und Vermeidung von Hypoglykämien eine Herausforderung, sagte Dr. Pratik Choudhary, King’s College Hospital, London. 25–30 % der Patienten mit Typ-1-Diabetes nehmen Hypoglykämien eingeschränkt wahr. Jeder Dritte erleidet jährlich eine schwere Unterzuckerung, 5 % sogar mehrere pro Jahr. Auf der Inseltransplantation liegen somit große Hoffnungen: die Wiederherstellung einer physiologischen Insulinversorgung mit geringem Hypoglykämierisiko.
Sicherheit und Effektivität steigen kontinuierlich
Die ersten Eingriffe liegen schon rund 20 Jahre zurück. In Europa sind seither 1600 Transplantationen bei 900 Patienten erfolgt, die USA kommen auf 900 Transplantationen bei knapp 400 Patienten. Die Ergebnisse sind mit den Jahren immer besser geworden. Kam anfangs noch einer von vier Patienten drei Jahre nach der letzten Infusion ohne Insulin aus, waren es im Jahr 2000 schon 44 %. Durch aggressive Immunsuppression mit T-Zelldepletion plus TNF-α-Inhibition und Interleukin-2-Rezeptorantikörper lassen sich die Raten noch weiter nach oben schrauben. Parallel dazu ist der Eingriff immer sicherer geworden, schwere Komplikationen kommen kaum noch vor und Todesfälle in den letzten Jahr gar nicht mehr. Daten des US-Registers CITR weisen zudem aus, dass die Rate schwerer Hypoglykämien bei transplantierten Patienten um über 90 % zurückgegangen ist – „auch bei denen, die wieder Insulin brauchen“, betonte der Endokrinologe.
Spicker: Was ist was?
- β-Score:
Score zur Bewertung der Betazell-Funktion nach Inseltransplantation (Skala: 0–8)
- Autologe Stammzellen:
Stammzellen, die vom Empfänger selbst stammen - Allogene Stammzellen:
Die Stammzellen stammen von einem geeigneten Spender. - Perizyten:
Kontraktile Bindegewebszellen, die gemeinsam mit den Endothelzellen die Blutkapillaren bilden.
Welche Ansätze sind zukunkftsträchtig?
Forschungsgruppen wie die von Professor Dr. Jay S. Skyler vom Diabetesforschungszentrum der University of Miami arbeiten daran, die Organspende überflüssig zu machen, indem sie Betazellen und ganze Pankreasinseln im Reagenzglas züchten. Sie nutzen dazu Stammzellen, was den Charme hat, dass es die Immunsuppression überflüssig machen könnte. Das funktioniert bei Zellen noch nicht ganz, erscheint aber machbar. „Selbst bei autologen Stammzellen ist mit autoimmunen Reaktionen zu rechnen, sodass eine gewisse Immunmodulation erforderlich sein dürfte“, so Prof. Skyler. Allogene Stammzellen wirken stärker immunogen, bieten aber den Vorteil, dass sie per Zellbanken in nahezu unbegrenzter Menge zur Verfügung gestellt werden können. Für die kommerzielle Nutzung stellt das sicher die interessantere Option dar. Beide Ansätze werden bereits von Unternehmen verfolgt, berichtete der Kollege. Orgenesis in Germantown, USA, etwa arbeitet an einem Verfahren, das Leberzellen des Patienten in einem vielstufigen Prozess in glukosesensible hormonproduzierende Pankreaszellen umprogrammiert. PDX1, auch als Insulin Promoting Factor 1 bekannt, spielt dabei eine Schlüsselrolle. Die genetische Information dafür schleust ein Adenovirus in die ehemaligen Leberzellen. Mit allogenen embryonalen Stammzellen arbeitet u.a. das in San Diego ansässige Unternehmen ViaCyte. Die Zwickmühle besteht darin, dass eigentlich eine offene „Verpackung“ für den Pankreasinselersatz nötig ist, um die Vaskularisierung zu sichern. Andererseits erlaubt das aber Attacken durch das Empfängerimmunsystem. Ein geschlossenes Depot hält das Immunsystem fern, aber die Versorgung durch Diffusion funktioniert weniger gut, als wenn Gefäße einwachsen können. Beide Systeme befinden sich in der klinischen Erprobung, aber am vielversprechendsten erscheint ein drittes, PEC-QT genannt, das gegenwärtig entwickelt wird: Dabei werden die Zellen so transformiert, dass das Immunsystem sie nicht als fremd erkennt („immunevasiv“). So können sie ohne Immunsuppression im offenen Implantat bleiben. Die Implantate werden nicht ins Pankreas eingesetzt, sondern subkutan, wo sie sich im Zweifelsfall einfach wieder entfernen lassen.Transplantation: Welche Patienten kommen infrage?
Fernziel sind funktionsfähige Langerhansinseln
Quelle: 12th International Conference on Advanced Technologies & Treatments in Diabetes (ATTD)
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).