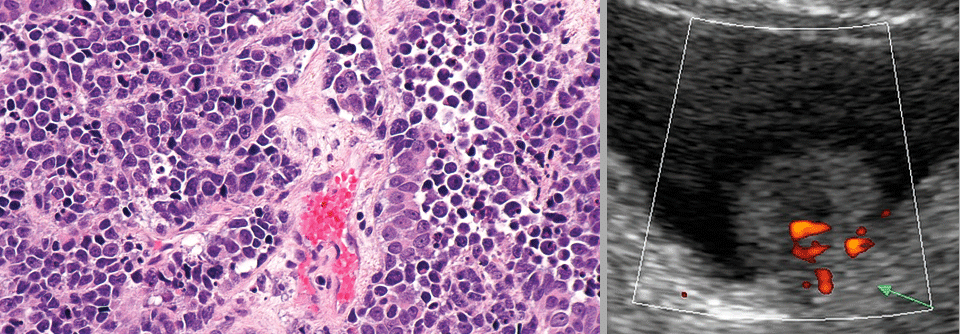
Wie lässt sich der derzeitige Backbone optimieren?
 Die perioperative systemische Behandlung spielt bei der Verbesserung des Langzeitüberlebens von MIBC Betroffenen eine große Rolle.
© pikovit – stock.adobe.com
Die perioperative systemische Behandlung spielt bei der Verbesserung des Langzeitüberlebens von MIBC Betroffenen eine große Rolle.
© pikovit – stock.adobe.com
So richtig zufrieden können wir derzeit beim MIBC nicht sein. Wenn man ehrlich ist, sollte es besser gehen“, konstatierte Prof. Dr. Margitta Retz, Urologische Klinik und Poliklinik, Klinikum rechts der Isar in München, und skizzierte den Unmet Need, der für Patient:innen mit muskelinvasivem Blasenkarzinom besteht.1 Zu den Problemen gehörten unter anderem, dass neoadjuvante Chemotherapien noch zu selten durchgeführt würden und dass ein großer Teil der Betroffenen nicht Cisplatin-fähig sei.
Die Leitlinien der EAU und der ESMO empfehlen für Erkrankte mit MIBC eine neoadjuvante cisplatinbasierte Chemotherapie. Bei gutem postoperativem Ansprechen (≤ ypT1 / pN0) folgt dann die Nachsorge. „Eine neoadjuvante Therapie zeigt uns auch, wie gut der Tumor anspricht. Patient:innen mit komplettem pathologischem Ansprechen haben ein exzellentes Überleben“, ergänzte Prof. Retz. Weniger klar sei das Vorgehen im Fall von Personen, die nach NACT und Zystektomie noch immer ein muskelinvasives Karzinom oder positive Lymphknoten (ypT2-T4 / pN+) und damit ein hohes Rezidivrisiko aufweisen.
Offene Fragen sind zu klären
Ein weiteres Problem seien Betroffene, die nach alleiniger Zystektomie ein lokal fortgeschrittenes Karzinom haben oder Lymphknoten-positiv sind (pT3-4 / pN+). Sie sollten eine adjuvante cisplatinbasierte Chemotherapie erhalten. „Aber hier haben wir eine Lücke: Was machen wir mit diesen Patient:innen, wenn sie eben nicht Cisplatin-fähig sind? Können wir bei ihnen durch die Immuntherapie mit Checkpoint-Inhibitoren einen besseren Effekt erreichen?“, fragte Prof. Retz.
Für die Adjuvanz liegen bereits Phase-3-Daten zur Checkpoint-Inhibition vor. Sowohl in die CheckMate-274-Studie mit Nivolumab als auch in die IMvigor010-Studie mit Atezolizumab wurden eingeschlossen:
- Cisplatin-unfähige Erkrankte, die keine NACT erhalten hatten, sowie
- Betroffene, die zwar mit einer vorherigen NACT behandelt worden waren, aber danach noch immer einen muskelinvasiven Tumor oder befallene Lymphknoten aufwiesen.
Daten aus der AMBASSADOR-Studie mit Pembrolizumab würden in Kürze erwartet, so Prof. Retz. In CheckMate 274 wurde ein signifikanter Vorteil hinsichtlich des krankheitsfreien Überlebens (DFS) beobachtet.2 Die Ergebnisse führten zur Zulassung von Nivolumab für Betroffene mit hohem Rezidivrisiko (pT3, pT4 oder pN+; ypT2 – ypT4 oder ypN+) bei nachgewiesener PD-L1-Expression auf den Tumorzellen (≥ 1 %) nach radikaler Zystektomie. Am stärksten von adjuvantem Nivolumab profitieren Teilnehmende mit Harnblasenkarzinom, mit befallenen Lymphknoten und jene, die neoadjuvant Cisplatin erhalten hatten. „Damit können wir eine Lücke schließen: Bei High-Risk-Blasenkarzinomen, die PD-L1-positiv sind, können wir Nivolumab einsetzen. Das gilt auch für Cisplatin-unfähige Patient:innen, die keine NACT erhielten“, fasste Prof. Retz zusammen.
Die IMvigor010-Studie mit adjuvantem Atezolizumab verfehlte ihren primären Endpunkt und ergab keine signifikante DFS-Verlängerung durch Atezolizumab gegenüber der Beobachtungsgruppe.3
CPI vor der Operation?
Auch in der Neoadjuvanz wurden immunonkologische Strategien bereits evaluiert, allerdings nur in kleinen Machbarkeitsstudien (NABUCCO mit Ipilimumab plus Nivolumab) und in Phase-2-Untersuchungen (PURE-01 mit Pembrolizumab und ABACUS mit Atezolizumab). Die Ansprechraten waren vielversprechend. „Hier haben wir möglicherweise Hinweise auf ein neues Konzept“, kommentierte Prof. Retz. Aufgrund fehlender Phase-3-Daten hätten die Ergebnisse aber noch keinen Einfluss auf die klinische Praxis.
Die Suche nach prädiktiven Biomarkern für die neoadjuvante Therapie wie Reparaturgene, Proliferationsmarker oder molekulare Subtypen lieferte bisher nur hypothesengenerierende Daten, die nicht prospektiv untersucht wurden, so Prof. Retz. Sie verwies auf die Bestimmung und Überwachung der ctDNA im Rahmen der IMvigor-Studie.4 Diese diente zunächst zur Detektion einer minimalen Resterkrankung und von Mikrometastasen nach der OP und anschließend zum Monitoring des Therapieansprechens auf adjuvantes Atezolizumab. In der auf diesen Ergebnissen aufbauenden Studie IMvigor011 prüfen Wissenschaftler:innen Atezolizumab bei ctDNA-positiven Patient:innen mit Hochrisiko-MIBC nach Zystektomie. Derzeit wird auch in Deutschland rekrutiert.
Außerdem evaluieren Forschende sogenannte Sandwich-Modelle mit neoadjuvanter Chemoimmuntherapie gefolgt von Zystektomie und einer adjuvanten Immun-Erhaltungstherapie:
- In der Phase-3-Studie ENERGIZE wird dieses Konzept mit Nivolumab und Gemcitabin/Cisplatin bei Cisplatin-geeigneten Patient:innen untersucht.
- Die Phase-3-Studie VOLGA umfasst Cisplatin-ungeeignete Personen. In der Neoadjuvanz erhalten die Teilnehmenden entweder Durvalumab plus Tremelimumab und das Antikörper-Wirkstoff-Konjugat Enfortumab-Vedotin (EV) oder Durvalumab plus EV oder keine neoadjuvante systemische Behandlung. Die Immunerhaltungstherapie besteht entweder aus beiden CPI oder alleinigem Durvalumab oder im dritten Arm bei hohem Risiko aus Nivolumab.
- Die KEYNOTE-905/EV-303-Studie schließt ebenfalls Cisplatin-ungeeignete Erkrankte ein. Kolleg:innen verfolgen darin ein ähnliches Konzept wie in VOLGA, nur dass die Immuntherapie aus Pembrolizumab besteht und EV teilweise auch in der Adjuvanz gegeben wird.
Eine weitere Option für Cisplatin-ungeeignete Patient:innen ist die in SunRISe-4 geprüfte neoadjuvante Chemoimmuntherapie mit TAR-200 und Cetrelimab. Das System TAR-200 wird mit einem transurethralen Katheter platziert und setzt während der Verweildauer in der Blase kontinuierlich Gemcitabin frei.
Abschließend stellte Prof. Retz die Frage, ob eine Zystektomie tatsächlich für alle Betroffenen notwendig sei und verwies auf die beim ASCO-GU 2023 präsentierte Phase-2-Studie HCRN GU 16-257. Darin führte Gemcitabin, Cisplatin und Nivolumab nach transurethraler Tumorresektion zu einer Rate an klinischem Komplettansprechen von 43 %.
Quellen:
1. Retz M. 75. Kongress der DGU; Vortrag „MIBC – Wenn Chemotherapie und Operation nicht genug sind“
2. Bajorin DF et al. N Engl J Med 2021; 384: 2102-14; DOI: 10.1056/NEJMoa2034442
3. Bellmunt J et al. Lancet Oncol 2021; 22: 525-537; DOI: 10.1016/S1470-2045(21)00004-8
4. Powles T et al. Nature 2021; 595: 432-37; DOI: 10.1038/s41586-021-03642-9
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).