Mastzellaktivierungserkrankung Betroffene landen zumeist in der psychosomatischen Schublade
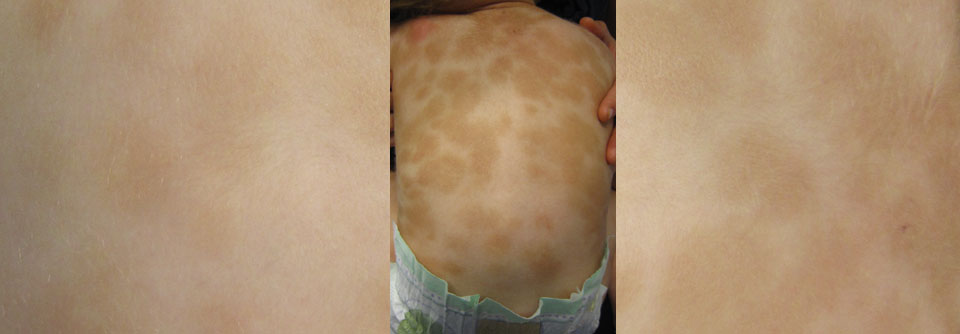
 Der Zeitraum, bis sich die Erkrankung überhaupt manifestiert, ist individuell sehr unterschiedlich.
© JosLuis- stock.adobe.com
Der Zeitraum, bis sich die Erkrankung überhaupt manifestiert, ist individuell sehr unterschiedlich.
© JosLuis- stock.adobe.com
Was versteht man unter einer Mastzellaktivierungserkrankung?
Prof. Dr. Molderings: Wenn sich eine Beschwerdenkonstellation auf die unangemessene Freisetzung von Botenstoffen aus Mastzellen zurückführen lässt, spricht man zuallererst von einem Mastzellmediatorfreisetzungssyndrom. Ob dieses durch eine systemische Mastzellaktivierungserkrankung (MCAD) hervorgerufen wird, muss man abklären.
Das, was historisch systemische Mastozytose genannt wird, ist nur eine Variante einer solchen Erkrankung. 1996 fand man erstmals eine Mutation, die bei Betroffenen fast immer vorhanden war. Und lange Zeit dachte man, solch eine Mutation müsse bei einer MCAD zwingend vorliegen. Später zeigte sich, dass es auch Varianten der MCAD ohne diese Mutation gibt.
Seit einigen Jahren weiß man, dass es in mindestens 35 verschiedenen Genen eine Vielzahl von Mutationen geben kann, die in ganz unterschiedlichen Kombinationen zu einer systemischen Mastzellaktivierungserkrankung führen können. Daraus resultiert, dass jeder Patient seine individuelle Kombination an genetischen und vor allem epigenetischen Veränderungen in sich trägt und damit auch seine ganz individuelle Beschwerdekombination.
Gibt es eine Erklärung dafür, warum es zu den epigenetischen Veränderungen kam?
Prof. Dr. Molderings: Die epigenetische Störung entstand höchstwahrscheinlich in der Zeit zwischen 1905 und 1920. Seitdem wird sie von Generation zu Generation weitergegeben und tritt immer intensiver und früher auf. Über die Faktoren, die Anfang des 20. Jahrhunderts dazu geführt haben, kann man nur spekulieren. Das war die Zeit des Weltkriegs, der Spanischen Grippe, der Industriellen Revolution –das kann alles eine Rolle gespielt haben.
Sie sagten gerade, dass die Erkrankung in immer jüngeren Jahren auftritt. D.h., es gibt keinen klaren Altersgipfel?
Prof. Dr. Molderings: Nein, es gibt keinen Altersgipfel in der Hinsicht. Was vor 20 Jahren eine Rarität war, sehen wir heute häufig, – nämlich dass Kinder mit zehn Jahren aufgrund ihrer Beschwerden nicht in die Schule gehen können. Diese Kinder machen mir Kopfzerbrechen, weil sie sehr schwer zu behandeln sind. Sie haben die meisten genetischen Veränderungen.
Der Zeitraum, bis sich die Erkrankung überhaupt manifestiert, ist individuell sehr unterschiedlich. Es müssen erst mal so viele autonom aktivierte mutierte Mastzellen und sekundär aktivierte gesunde Mastzellen im Körper vorhanden sein, dass die Konzentration der freigesetzten Botenstoffe ausreicht, um Beschwerden hervorzurufen. Erst treten diese nur phasenweise auf. Dann werden die symptomfreien Intervalle immer kürzer, bis irgendwann die Erkrankung ständig vorhanden ist.
Was ruft die erstmalige Manifestation und erneute symptomatische Episoden hervor?
Prof. Dr. Molderings: Die möglichen Trigger sind mannigfaltig: Operationen, Impfungen, Allergien, die der Patient erwirbt, Infektionskrankheiten. Die Mastzellen nehmen eine zentrale Stellung im Immunsystem ein, weswegen jede immunologische (Ausnahme-)Situation im weitesten Sinne ein Trigger sein kann.
Bei welchen Patienten sollte der Arzt an eine MCAD denken?
Prof. Dr. Molderings: Die Erkrankung kann potenziell jedes Körpergewebe beeinflussen, die Symptome nehmen subakut oder chronisch zu- oder ab oder treten episodisch auf. Die Patienten berichten von Attacken, Anfällen oder Schüben. Wenn der Arzt das hört, muss es bei ihm „klick“ machen. Außerdem sollte er wissen, dass sich die Befundkonstellationen erheblich unterscheiden, es gibt zahllose klinische Varianten.
Manch ein Patient kommt mit Befunden von zig Fachärzten und in fast jedem heißt es, man finde zwar marginale Veränderungen, aber das alleine erkläre nicht die Symptomatik. Dies ist der Punkt, der den Verdacht auf eine systemische Mastzellaktivierungserkrankung lenken sollte.
Gibt es bestimmte Diagnosen oder Erkrankungen, die an MCAD denken lassen sollten?
Prof. Dr. Molderings: Bereits 2011 haben wir in Untersuchungen zeigen können, dass mindestens 75 % der therapierefraktären Reizdarmpatienten eine MCAD haben. Daher sollte ein Arzt beim Stichwort Reizdarm auch an MCAD denken. Ähnliches gilt z.B. für das Fibromyalgiesyndrom und die interstitielle Zystitis.
Charakteristisch für die Mastzellerkrankung ist auch das folgende Beispiel: Ein Patient berichtet, dass er bis vor Kurzem keine Äpfel vertragen hat, sie nun aber wieder ohne Beschwerden essen kann. Wenige Wochen später taucht derselbe Patient erneut in der Sprechstunde auf und sagt, er vertrage nun doch keine Äpfel mehr. Ich garantiere, dass er in 99,9 % der Fälle in die psychosomatische Schublade gesteckt wird.
Man muss als Arzt den Patienten auch die bizarrst anmutenden Beschwerdebeschreibungen glauben wollen. Wenn ich das nicht tue, kann ich keinen MCAD-Verdacht entwickeln und keine Therapie oder Differenzialdiagnose ins Auge fassen.
Welche diagnostischen Schritte sind bei Verdacht auf MCAD zu gehen?
Prof. Dr. Molderings: In unserem Bonner Arbeitskreis empfehlen wir als erstes, dass man z.B. unsere Checkliste (oder eine Ähnliche verwendet, um zu überprüfen, ob ein Mastzellmediatorfreisetzungssyndrom vorliegt. Damit hat man schon mal ein diagnostisches Kriterium. Zudem sollte man Mastzellbotenstoffe bestimmen: Tryptase im Serum, Histamin im Blut oder – noch besser – Methylhistamin im Urin. Dazu kommen Chromogranin A im Blut, Serotonin im Blut bzw. das Abbauprodukt davon im Urin, ggf. Leukotriene und Heparin im Blut.
Da bei nahezu allen Patienten eine Gastritis besteht und die meisten über Darmbeschwerden klagen, muss man eine Gastro- und Koloskopie durchführen und auch aus unverdächtigen Stellen Biopsien entnehmen. Die Proben werden immunhistochemisch untersucht mit Anti-Tryptase-, Anti-CD117-und Anti-CD25-Antikörpern. Wenn man in mindestens einer Probe eine erhöhte Dichte an Mastzellen oder eine erhöhte Aktivierung von Mastzellen findet, ist ein weiteres Diagnosekriterium erfüllt. Manche Mutationskombinationen führen dazu, dass die Mastzellen statt rund spindelförmig aussehen. Trifft dies auf 25 % der Mastzellen zu, hat man ein weiteres Kriterium.
Der Arzt kann den Patienten auch probatorisch mit H1- oder H2-Antihistaminika und retardiertem Vitamin C behandeln. Bessern sich die Beschwerden darunter, ist dies als Zeichen für eine Mastzellbeteiligung und als weiteres Kriterium zu werten. Die Diagnose ist formal gesichert, wenn das Hauptkriterium (Mastzellmediatorfreisetzungssyndrom) und ein Nebenkriterium vorliegt.
Welche weiteren Untersuchungen sind sinnvoll?
Prof. Dr. Molderings: Nahezu alle Patienten weisen eine gesteigerte Fibrinolyse auf, viele berichten deswegen über das Auftreten von blauen Flecken nach Minimaltraumen bzw. ohne erinnertes Trauma. Gleichzeitig kann eine Thrombophilie vorliegen. Ich empfehle daher jedem Kollegen, MCAD-Patienten an einen Arzt für Transfusionsmedizin zu überweisen mit der Bitte um eine MCAD-spezifische Gerinnungsdiagnostik.
Wie wird die MCAD behandelt?
Prof. Dr. Molderings: Um die Mastzellaktivität zu reduzieren, gibt man als Basistherapie H1- und H2-Antihistamika sowie 500 mg Vitamin C in retardierter Form. Außerdem kann man noch Ketotifen geben. Bei Patienten mit einer Dominanz der intestinalen Symptomatik ist Cromoglicinsäure sinnvoll. Sie ist für diese Indikation zugelassen und wird von der Krankenkasse bezahlt.
Dazu kommt fakultativ die symptomatische Therapie. Dabei kommt es darauf an, welches Organ betroffen ist. Protonenpumpenhemmer sind wegen der bei praktisch allen MCAD-Patienten bestehenden Gastritis nahezu obligat.
Es gibt also nicht die eine Medikation, die jedem Patienten hilft. Für die behandelnden Ärzte ist das sicher eine Herausforderung.
Prof. Dr. Molderings: Durchaus, denn die Patienten müssen alle paar Wochen beim Arzt vorstellig werden. Und der muss sich für sie Zeit nehmen – mehr Zeit als für den Durchschnittspatienten und mehr Zeit, als die Krankenkassen bezahlen. Er hat zu besprechen, was besser geworden ist, was schlechter. Er muss sich darüber klar werden, welche Medikamente er hinzugeben und welche weglassen sollte, bei welchen er die Dosis erhöhen oder erniedrigen kann. Der Zeitfaktor ist ein wichtiger Grund dafür, dass die Patienten kaum Ärzte finden, die sie adäquat behandeln, und dafür, dass sie in der Schublade „somatoforme Störung“ landen.
Wie kann man es schaffen, dass sich mehr Ärzte mit MCAD auseinandersetzen?
Prof. Dr. Molderings: Fortbildungsangebote zu dem Thema gibt es. Aber die wesentlichen Einwände der niedergelassenen Kollegen lauten: „Es dauert ja viel zu lange, die Diagnose zu stellen!“ und „Die Therapie übersteigt mein Budget.“ Da kann nur eine grundsätzliche Änderung unseres Gesundheitssystems etwas bewirken. Die Entwicklung des Gesundheitssystems unter primär ökonomischen Aspekten geht heute einfach in die komplett falsche Richtung.
Derzeit sorgt Long COVID für Kopfzerbrechen – die Beschwerden sind zum Teil ganz ähnlich wie bei MCAD. Gibt es einen Zusammenhang?
Prof. Dr. Molderings: Den gibt es, aber man weiß nicht, ob das nur eine Assoziation ist oder ob eine Kausalität besteht. Man kann ausprobieren, ob mastzellhemmende Medikamente zu einer Besserung der Long-COVID-Symptome beitragen. Der potenzielle Nutzen überwiegt das Risiko. Long COVID ist aber wohl keine primäre Mastzellerkrankung, die Mastzellen scheinen sekundär beteiligt zu sein.
Wie sieht die therapeutische Zukunft bei der MCAD aus?
Prof. Dr. Molderings: Für die Therapie der MCAD sind Medikamente in der Pipeline, um die aktivierten Mastzellen weitgehend ruhigzustellen, die nicht-aktivierten Mastzellen aber unbeeinflusst zu lassen. Mit ihnen kann man nach und nach eine Besserung oder ein Verschwinden der Symptomatik erreichen. Diese Therapeutika werden wahrscheinlich in zweieinhalb bis vier Jahren verfügbar sein.
Aufbauend auf diesen Medikamenten ist man dabei, Substanzen zu entwickeln, die gezielt in den aktivierten Mastzellen die Apoptose induzieren. Ziel ist eine Mastzelldichte wie vor der Erstmanifestation der Erkrankung. Natürlich werden die nach wie vor vorhandenen Trigger irgendwann wieder zur Erkrankung führen. Dann müsste man die Therapie wiederholen. In der Zwischenzeit hätte man eine Quasi-Heilung und der Patient könnte ein weitgehend normales oder beschwerdearmes Leben führen. Diese Therapieoption sehe ich in frühestens acht bis neun Jahren.
Interview: Kathrin Strobel