Haut- und Weichteilinfektionen Der Erreger-Invasion ein Ende setzen
 Staph. aureus verursacht nicht immer Infektionen. Er kommt auch auf gesunder Haut vor.
© nobeastsofierce – stock.adobe.com
Staph. aureus verursacht nicht immer Infektionen. Er kommt auch auf gesunder Haut vor.
© nobeastsofierce – stock.adobe.com
Infektionen von Haut- und Weichgewebe können unkompliziert und eher oberflächlich verlaufen oder zu Komplikationen und prolongierten Klinikaufenthalten führen. Für Letzteres sorgen beispielsweise resistente Keime oder patientenspezifische Faktoren wie chronische Hauterkrankungen, schreiben Emilio Bouza von der Universitätsklinik Gregorio Maranón, Madrid, und Kollegen.
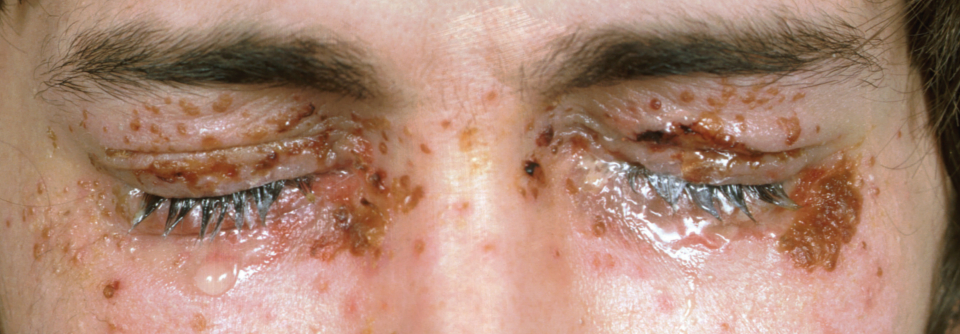
Zellulitis, Erysipel oder eine andere akute bakterielle Infektion der Haut- und Hautstrukturen sind bei Patienten mit chronischen nicht-infektiösen Dermatosen keine Seltenheit. Ein Paradebeispiel ist die AD, bei der durch die chronisch gestörte Hautbarriere den Keimen Tür und Tor offen steht. Wie lässt sich das am besten managen?
Ein essenzieller Punkt für die adäquate Versorgung der Patienten heißt: Zusammenarbeit. Wird die bestehende Erkrankung durch eine Infektion verkompliziert, kann es wichtig werden, dass Dermatologe und Infektiologe an einem Strang ziehen. Außerdem sollten sie sich nicht davor scheuen, einen Mikrobiologen hinzuzuziehen, z.B. bei besonders schweren Infektionen, wenn ein ungewöhnlicher Keim als Auslöser vermutet wird oder bei unzureichendem Ansprechen auf die Antibiose. Auch für Monitoring und epidemiologische Erhebungen kann eine mikrobiologische Diagnostik erforderlich sein.
Das diverse Haut-Mikrobiom macht es allerdings nicht ganz einfach, den verantwortlichen Organismus zu finden, da die pathologische von einer physiologischen Kolonisierung abgegrenzt werden muss. Die Qualität der entnommenen Probe spielt eine entscheidende Rolle: Bakterielle Kulturen aus (wenn möglich) tiefen Gewebeproben bringen zuverlässigere Ergebnisse als oberflächliche Abstriche. Die dafür nötigen Gewebebiopsien und -aspirationen sind der Goldstandard bei schwerer Infektion, systemischen Symptomen oder Versagen der Initialtherapie. Allerdings muss man auch berücksichtigen, dass die entnommene Probe lokal begrenzt ist und nicht das ganze Keimspektrum abdecken muss. Tiefe Gewebebiopsien erfolgen unter örtlicher Betäubung.
Bei oberflächlichen eitrigen oder nässenden Wunden können für die Kultur auch Wundflüssigkeiten (Exsudat auch für Gramfärbung nutzbar) verwendet werden, ggf. muss man den Abszess drainieren/aspirieren. In Abwesenheit von Flüssigkeiten (z.B. bei einem Ulkus) wird etwas Wundgewebe entnommen.
Schnell, schneller, PCR
Eine konventionelle Bakterienkultur braucht Zeit, sodass zunächst empirisch behandelt werden muss. Dieses Problem kann durch den Einsatz von molekularen Schnelltests umgangen werden. PCR-Assays ermöglichen eine rasche und präzise Identifikation von Staph. aureus und MRSA aus Wundproben und erleichtern in diesen Fällen die frühe Einleitung einer gezielten Antibiose – bereits Tage, bevor das Ergebnis der Bakterienkultur vorliegt.
Bei Beteiligung tieferer Schichten ab ins Krankenhaus
Besteht kein Verdacht auf Sepsis muss ein Patient mit unkomplizierter Infektion nicht stationär behandelt werden, es sei denn, es gibt andere Faktoren (u.a. Komorbiditäten, Immunsuppression, schlechte Therapietreue), die dafür sprechen. Anders sieht es bei komplizierten Infektionen aus (siehe Kasten), z.B. wenn man Faszien- oder Muskelbeteiligung vermutet, die Infektion sich rapide ausbreitet oder eine Nekrose droht.
Vorgeschlagene Klassifizierung
Unkomplizierte Haut- und Weichgewebeinfektionen (uncomplicated skin and soft tissue infections, uSSTI):
- oberflächlich
- keine stationäre Aufnahme nötig
- keine OP/Drainage nötig
- beschränkte Ausdrehung
- nicht progredient
- milde klinische Ausprägung
- Beispiele: Impetigo, Ekthyma
Komplizierte Haut- und Weichgewebeinfektionen (complicated skin and soft tissue infections, cSSTI):
- tiefe Hautschichten beteiligt
- stationäre Aufnahme nötig
- OP/Drainage nötig
- größere betroffene Fläche
- progredient
- schwere klinische Ausprägung
- Beispiele: komplexe Abszesse, Fasziitis, Myonekrose
Akute bakterielle Infektionen der Haut und Hautstrukturen (acute bacterial skin and skin structure infektions, ABSSSI):
- je nach Infektion oberflächlich oder bis in tiefe Schichten reichend
- stationäre Aufnahme nötig
- OP/Drainage bei Wundinfektionen oder Abszessen
- betroffene Fläche > 75 cm²
- progredient
- schwere klinische Ausprägung
- häufigste Erreger: Staph. aureus (inkl. MRSA), Streptococcus pyogenes
- Beispiele: Zellulitis, Erysipel, große Abszesse und Wundinfektionen
Anamnese und körperliche Untersuchung geben Hinweise auf den wahrscheinlichsten Keim (und die Resistenzlage). Da als bakterielle Auslöser in erster Linie S. aureus, S. pyogenes und andere betahämolysierende Streptokokken infrage kommen, eignen sich initial gegen grampositive Bakterien wirksame Antibiotika – zusätzlich zu eventuell erforderlichen chirurgischen Maßnahmen. Gramnegative Erreger mit abzudecken ist empirisch nicht indiziert. Falls jedoch eine polymikrobielle Infektion vermutet wird oder das Gewebe bereits nekrotisiert, sollte die Antibiose breiter aufgestellt sein und auch auf diese Keime (inkl. Anaerobier) abzielen. Da MRSA bei Haut- und Weichgewebeinfektionen durchaus eine Rolle spielen, empfehlen die Experten u.U. direkt eine empirische Antibiose gegen lokal verbreitete MRSA-Stämme zu erwägen (z.B. bei purulenten Infektionen oder Hochrisikopatienten).
Die Wirksamkeit des empirischen Ansatzes sollte man 48 bis 72 Stunden nach Beginn beurteilen. Je nach den Ergebnissen von Bakterienkultur und Antibiogramm und abhängig vom klinischen Status des Patienten (Fieber, Leukozytose, Entzündungsparameter) muss die antibiotische Therapie ggf. angepasst werden.
Langwirksame Antibiotika als Gamechanger?
Ein Nachteil der „üblichen“ Antibiotika ist, dass sie oft mehrmals täglich eingenommen werden müssen, was zu Adhärenzproblemen, gastrointestinalen Nebenwirkungen und Resistenzentwicklung führen kann, schreiben die Autoren. Langwirksame Antibiotika wie Dalbavancin oder Oritavancin erfordern teilweise nur eine einzige Infusion und gelten als sicher. Diese Substanzen könnten zukünftig das Management von bakteriellen Hautinfektionen deutlich vereinfachen und zu einer Reduktion der Kosten beitragen.
Quelle: Bouza E et al. JEADV Clin Pract 2022; 1-11; DOI: 10.1002/jvc2.43