Rezidivierende Glioblastome Doppelschlag gegen aggressiven Hirntumor
 Eine CAR-T-Zell-Therapie hat nach ersten Studienergebnissen vielversprechende Ergebnisse zur Behandlung des Glioblastoms gezeigt.
© Leo – stock.adobe.com
Eine CAR-T-Zell-Therapie hat nach ersten Studienergebnissen vielversprechende Ergebnisse zur Behandlung des Glioblastoms gezeigt.
© Leo – stock.adobe.com
Das Glioblastom ist nicht nur der häufigste, sondern auch der aggressivste Hirntumor, der Erwachsene betrifft. Im Mittel bleiben Patienten nach der Diagnose nur noch 12–18 Lebensmonate. Chirurgie, Bestrahlung und Chemotherapie können die Lebenserwartung nur minimal verlängern. Bei fast allen Patienten kommt es trotz aggressivster Therapien zu Rezidiven. Wenn dies der Fall ist, schrumpft die restliche Lebenszeit auf Monate.
Von der Blutkrebstherapie zum soliden Tumor
Kürzlich wurden erstmals zwei verschiedene Konzepte einer CAR-T-Zell-Therapie beim rezidivierenden Glioblastom publiziert. Solche Behandlungen wurden bereits für hämatologische Neoplasien entwickelt und werden dort mit Erfolg eingesetzt. Ihr Prinzip besteht darin, körpereigene T-Zellen zu entnehmen und so zu reprogrammieren, dass sie spezifische Tumorantigene erkennen.
Bei soliden Tumoren ist diese Art von Therapie viel schwieriger umsetzbar als bei Leukämie und anderen Blutkrebsformen. Denn solide Tumoren wie Glioblastome präsentieren von Patient zu Patient, aber auch innerhalb eines Tumors heterogene Antigene. Dazu kommt, dass Glioblastome Escape-Mechanismen entwickeln, mit denen sie T-Zell-Attacken ausweichen können.
In einer noch laufenden Phase-1-Studie erhalten Patienten mit rezidivierendem Glioblastom erstmals eine CAR-T-Zell-Therapie, die sich nicht nur gegen eines, sondern gleich gegen zwei hirntumorassoziierte Proteine richtet: gegen den epidermal growth factor receptor (EGFR), den etwa 60 % aller Glioblastome aufweisen, und gegen den Interleukin-13-Rezeptor-alpha-2 (IL13Rα2), den mehr als 75 % aller Glioblastome exprimieren.
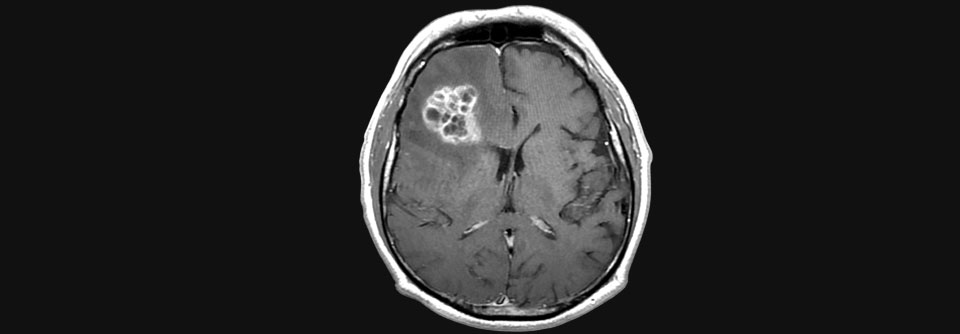
Die Ergebnisse sind nach einer frühen Analyse der ersten sechs Patienten vielversprechend, schreiben Autoren um Stephen Bagley von der University of Pennsylvania. MRT-Scans 24 bis 48 Stunden nach intrathekaler Injektion der CAR-T-Zell-Therapie zeigten, dass die Tumoren bei allen Patienten kleiner geworden waren und in einigen Fällen sogar mehrere Monate so blieben. Die erwartete Neurotoxizität der Therapie war beherrschbar.
Da diese Therapie nicht wie üblich intravenös gegeben wird, sondern intrathekal, kann sie die Tumoren noch direkter erreichen – über diesen Zugangsweg kann man die komplexen Abwehrmechanismen des Glioblastoms offenbar „austricksen“.
Einen ähnlichen Weg wählten Bryan Choi von der Harvard Medical School und Kollegen. In ihrer Phase-1-Studie kam erstmals ein Produkt zum Einsatz, das die CAR-T-Zell-Methode mit einem bispezifischen Antikörper (T-cell engaging antibody molecules; TEAM) gegen Wildtyp-EGFR-Rezeptoren und die tumorspezifische EGFR-Variante III kombiniert.
Die ersten Ergebnisse von drei Patienten mit rezidivierendem Glioblastom erscheinen ebenfalls aussichtsreich: Schon nach einer einzigen intraventrikulären Infusion von CAR-TEAM-Zellen nahmen die Tumoren innerhalb von Tagen an Größe ab. Bei einer Patientin sah man schon nach fünf Tagen eine nahezu vollständige Tumorregression.
Allerdings hielt die Tumorresponse bei zwei von drei Patienten nicht an. Künftig müsse man vielleicht den Einsatz der CAR-TEAM-Zellen in Kombination mit weiteren Strategien erproben, etwa einer Vorkonditionierung mit Chemotherapie, so die Autoren.
Quelle: 1. Bagley SJ et al. Nat Med 2024; DOI: 10.1038/s41591-024-02893-z
2. Choi BD et al. N Engl J Med 2024; 390: 1290-1298; DOI: 10.1056/NEJMoa2314390