Lymphangioleiomyomatose: Vor der Therapie muss die Diagnose absolut sicher stehen
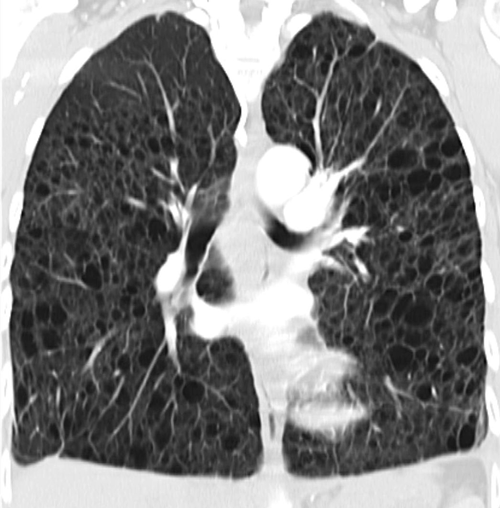
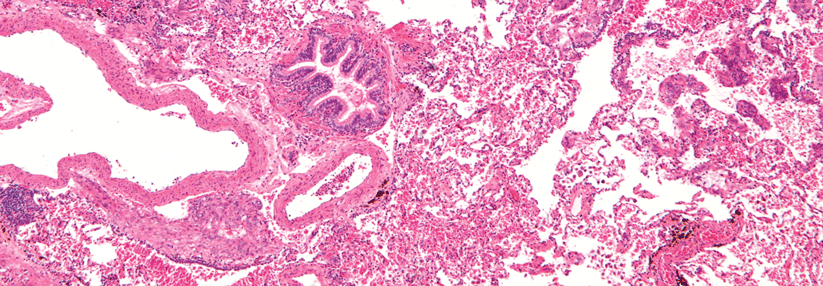 Bei der Lymphangioleiomyomatose kommt es zur unkontrollierte Proliferation glatter Muskelzellen.
© wikimedia/Nephron
Bei der Lymphangioleiomyomatose kommt es zur unkontrollierte Proliferation glatter Muskelzellen.
© wikimedia/Nephron
„Bevor ich eine junge Frau für den Rest ihres Lebens auf einen mTOR-Inhibitor einstelle, will ich zu 100 % sicher sein, dass die Diagnose stimmt“, betonte Professor Dr. Nishant Gupta von der Universität Cincinnati. Er ist Koautor der aktuellen amerikanisch-japanischen Leitlinie zur Lymphangioleiomyomatose (LAM), deren zentrale Inhalte und Hintergründe er vorstellte. Die meisten Empfehlungen stehen zwar auf schwachen Evidenzfüßen, aber das ist bei einer so seltenen Erkrankung nicht anders zu erwarten, erklärte der Kollege.
In den USA gibt es ca. 2000 diagnostizierte Fälle der Erkrankung, doch rechnet Prof. Gupta mit einer beträchtlichen Dunkelziffer, da viele Patienten lange unter Fehldiagnosen wie Asthma oder Emphysem laufen. Betroffen sind fast ausschließlich Frauen, die meisten von ihnen sind jung, ohne adäquate Therapie ist ihre Lebenserwartung verkürzt.
Die zugrunde liegende Mutation des Tuberöse-Sklerose-Gens TSC1 oder TSC2 induziert infolge von Überaktivität der mTOR-Kinase eine unkontrollierte Proliferation glatter Muskelzellen, was den Verlust an Lungenfunktion immer mehr beschleunigt. Im aggressiven Wachstum ähnelt die LAM malignen Erkrankungen, obwohl es sich nicht um Krebs im engeren Sinne handelt.
Aus diesen Erkenntnissen leitet sich die Therapie ab. Nach vielen fruchtlosen Versuchen etwa mit weiblichen Sexualhormonen oder Doxycyclin ist es mit dem mTOR-Inhibitor Sirolimus gelungen, den Lungenfunktionsverlust erheblich zu bremsen. In der Studie dazu verlor die Placebogruppe monatlich im Schnitt 12 ml FEV1, die Sirolimusgruppe dagegen nur 1 ml.
HRCT reicht nicht aus, um die Diagnose zu stellen
Natürlich ist ein mTOR-Inhibitor keine Zuckerpille und es will wohl abgewogen sein, ob eine Patientin ihn bekommen sollte. Die Leitlinie empfiehlt das Medikament, wenn eine Patientin bereits eine deutlich abnorme Lungenfunktion mitbringt oder rasch FEV1 einbüßt. Sirolimus eignet sich auch, um chylöse Flüssigkeitsansammlungen im Pleuraspalt aufzulösen. Es sollte bevorzugt eingesetzt werden, bevor man sich zur invasiven Drainage entschließt, betonte Prof. Gupta. Ob Everolimus ähnlich gute Effekte bringt, ist noch zu zeigen.
Aber wie gesagt: Erst muss die Diagnose sicher stehen. Das hochauflösende CT liefert wichtige Hinweise. Es zeigt multiple dünnwandige Zysten ohne Binnenstruktur, die sich gleichmäßig über beide Lungen verteilen. Aber es reicht allein nicht aus, um die LAM zu sichern. „In manchen Fällen, wenn die Patientin keine Symptome zeigt und das HRCT nur milde zystische Veränderungen, ist es okay, eine wahrscheinliche LAM zu diagnostizieren. Vor allem wenn daraus keine therapeutische Konsequenzen folgen“, sagte der Pneumologe. Voraussetzung ist, dass die Patientin regelmäßig zur Lungenfunktionskontrolle erscheint.
Sonst sollte im nächsten Schritt der vascular endothelial growth factor D (VEGF-D) im Serum gemessen werden. Wichtig: Es muss VEGF-D sein, nicht irgendein VEGF. Werte ≥ 800 pg/ml sichern die Diagnose mit 99%iger Wahrscheinlichkeit. Aber Vorsicht: Normalwerte unter 600 pg/ml schließen die LAM nicht aus. Alternativ führt auch der Nachweis einer TSC-Genmutation, von renalen Angiomyolipomen oder Lymphangioleiomyomen in Kombination mit dem HRCT zur Diagnose. Um letzte Zweifel auszuräumen, bleibt schließlich noch die Lungenbiopsie.
Eine letzte wichtige Empfehlung betrifft das Management von Patientinnen mit Spontanpneu, einer häufigen Komplikation der Lymphangioleiomyomatose. Die hohe Rezidivneigung (70 %) kann durch ipsilaterale Pleurodese halbiert werden. Befürchtungen, den Patientinnen dadurch die Ultima Ratio einer Lungentransplantation zu verbauen, haben sich nicht bewahrheitet. Es gibt nach Pleurodese zwar etwas mehr Operationskomplikationen, aber die Sterblichkeit ist nicht erhöht.
Quelle: ATS (American Thoracic Society) Conference 2018