Minimale Resterkrankung zur Risikostratifizierung bei triple-negativem Brustkrebs
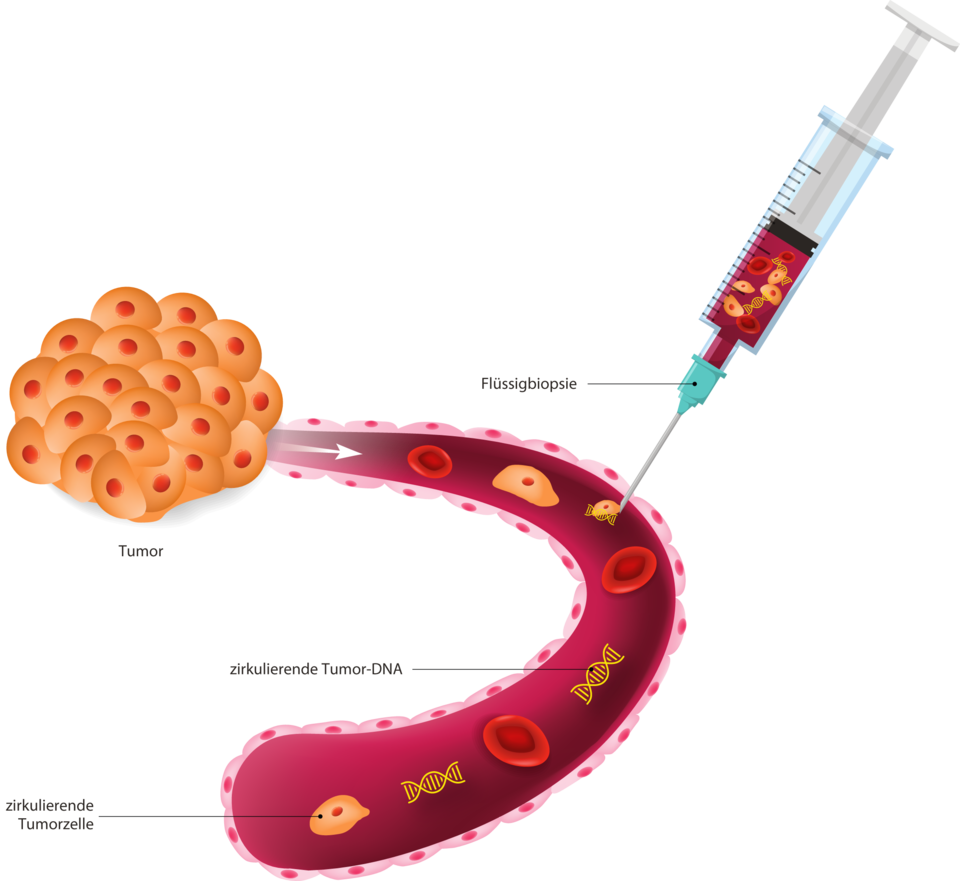
 Für das molekularanalytische Verfahren reicht etwas Blut aus – es bedarf keiner invasiven Probenentnahme wie bei einer klassischen Biopsie.
© designua – stock.adobe.com, djvstock – stock.adobe.com, istock/SergeiKorolko MT-Grafik; Wikipedia/Racheljunewong
Für das molekularanalytische Verfahren reicht etwas Blut aus – es bedarf keiner invasiven Probenentnahme wie bei einer klassischen Biopsie.
© designua – stock.adobe.com, djvstock – stock.adobe.com, istock/SergeiKorolko MT-Grafik; Wikipedia/Racheljunewong
Viele Patientinnen mit einem triple-negativen Mammakarzinom erhalten eine neoadjuvante Chemotherapie. In etwa einem Drittel der Fälle führt diese zu einer prognostisch günstigen pathologischen Komplettremission. Die übrigen zwei Drittel der Frauen sprechen dagegen nur unvollständig auf die Behandlung an und haben dementsprechend ein hohes Rezidivrisiko, berichten Forscher um Professor Dr. Milan Radovich vom Melvin and Bren Simon Comprehensive Cancer Center der Indiana University in Indianapolis.
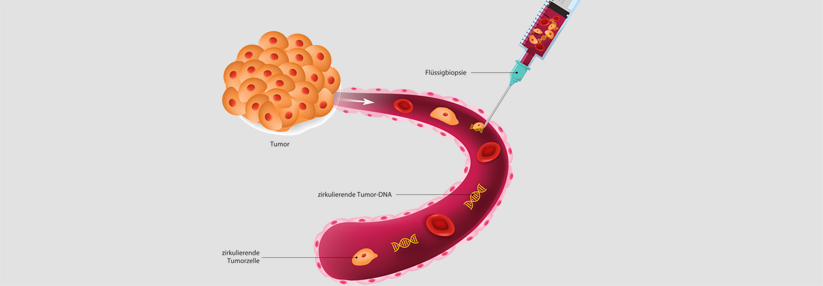
Ob nach dem chirurgischen Eingriff eine minimale Resterkrankung (MRD) vorliegt, lässt sich mittels Flüssigbiopsie feststellen: Im Blut zirkulierende Tumor-DNA (ctDNA) bzw. Tumorzellen deuten auf eine Tumorpersistenz hin. Die Autoren gingen nun der Frage nach, inwiefern der MRD-Status nach neoadjuvanter Therapie und Operation mit der onkologischen Prognose korreliert.
Dafür werteten sie im Rahmen einer geplanten Sekundäranalyse die Daten der randomisierten BRE12-158-Studie aus. Insgesamt 196 Teilnehmerinnen im medianen Alter von 49,6 Jahren gingen in die Analyse der multizentrischen Phase-2-Untersuchung ein.
Menge der Tumorzellen beeinflusste Prognose
Alle Patientinnen litten an einem triple-negativen Mammakarzinom im Frühstadium und wiesen nach der neoadjuvanten Chemo histopathologisch Tumorresiduen im Operationspräparat auf. Randomisiert erhielten sie entweder eine genomisch zielgerichtete oder eine Therapie nach Wahl des Arztes.
Anhand von postoperativ entnommenen Blutproben führten die Wissenschaftler eine ctDNA-Sequenzanalyse durch und zählten die zirkulierenden Tumorzellen. Anschließend prüften sie den Zusammenhang zwischen den Untersuchungsergebnissen und der Prognose der Frauen anhand folgender Faktoren: Überleben ohne distantes Erkrankungsrezidiv, erkrankungsfreies und Gesamtüberleben. Die mediane Nachbeobachtungszeit betrug im Studienkollektiv 17,2 Monate.
Lag bei Frauen ctDNA vor, ging dies mit einem signifikant schlechteren Überleben ohne distantes Erkrankungsrezidiv einher im Vergleich zu Teilnehmerinnen, bei denen keine ctDNA vorhanden war (median 32,5 Monate vs. nicht erreicht; Hazard Ratio [HR] 2,99; 95 %-KI 1,38–6,48). Auch das erkrankungsfreie Überleben fiel signifikant geringer in diesem Setting aus, mit median 22,8 Monaten im Vergleich zu nicht erreicht (HR 2,67; 95 %-KI 1,28–5,57), genauso wie das Gesamtüberleben (median nicht erreicht vs. nicht erreicht; HR 4,16; 95 %-KI 1,66–10,42). Nach 24 Monaten betrug die Wahrscheinlichkeit für ein Überleben ohne distantes Erkrankungsrezidiv bei ctDNA-Positivität 56 %, bei ctDNA-Negativität hingegen 81 %.
Der alleinige Nachweis zirkulierender Tumorzellen hatte zwar keinen wesentlichen Einfluss auf die Prognose der Frauen, allerdings bestand ein signifikanter Zusammenhang zwischen der quantitativen Tumorzelllast und den primären Studienendpunkten.
Deeskalation bei Frauen ohne minimale Resterkrankung?
Kombinierten die Wissenschaftler das Ergebnis der ctDNA-Analyse und der Zählung der zirkulierenden Tumorzellen, verbesserten sich die Sensitivität sowie die diskriminatorische Fähigkeit der Parameter. Patientinnen mit sowohl ctDNA- als auch Tumorzellnachweis wiesen im Vergleich zu ctDNA- und Tumorzell-Negativen ein signifikant schlechteres Überleben ohne distantes Erkrankungsrezidiv auf. Erneut beliefen sich die Werte auf median 32,5 Monate im Vergleich zu nicht erreicht, jedoch mit einer Hazard Ratio von 5,29 (95 % KI 1,50–18,62). Bezüglich des erkrankungsfreien Überlebens sowie des Gesamtüberlebens beobachteten die Forscher Ähnliches. Für die Autoren stellt sich demnach die Frage, ob für das „negative“ Studienkollektiv eine Deeskalationsstrategie infrage kommt.
Dass der MRD-Status im Blut einen wertvollen Prognose-Biomarker darstellt, bekräftigen die beiden Editorialisten Professor Dr. Andrew A. Davis und Professor Dr. Massimo Cristofanilli, Robert H. Lurie Comprehensive Cancer Center of Northwestern University, Chicago. Er „hat das Potenzial, die Therapie des triple-negativen, frühen Mammakarzinoms grundlegend zu verändern.“
Aktuell sind noch viele Fragen zum Biomarker offen
Bevor der MRD-Status jedoch im klinischen Alltag als Prognosemarker zum Einsatz kommen kann, seien noch eine Reihe wichtiger Fragen zu klären: Ab welchem Grenzwert gilt ein MRD-Test als positiv? Wie häufig und in welchem Zeitfenster gelingt es dem Organismus möglicherweise, zirkulierende Tumorprodukte vollständig abzubauen? Zu welchem Zeitpunkt und in welcher Frequenz sollte der MRD-Status anhand von Flüssigbiopsien erhoben werden? Und welche therapeutischen Konsequenzen gilt es insbesondere aus grenzwertigen Befunden zu ziehen?
Am dringlichsten aber sei herauszufinden, ob die MRD-basierende und risikoorientierte Präzisionstherapie die Prognose der Patientinnen verbessern kann. Eine von den Studienautoren bereits initiierte Untersuchung (PERSEVERE) beschäftigt sich nun u.a. mit dieser letzten Fragestellung.
Quellen:
1. Radovich M et al. JAMA Oncol 2020; e202295; DOI: 10.1001/jamaoncol.2020.2295
2. Davis A, Christofanilli M. A.a.O; DOI: 10.1001/jamaoncol.2020.2285