Was leisten MRT, Biopsie und Labor bei Herzmuskelerkrankungen?
 Einen hohen Stellenwert in der Diagnostik hat die MRT, weil kaum eine Methode nicht-invasiv so viele Informationen über den Zustand des Herzmuskels liefert. (Agenturfoto)
© iStock/Portra
Einen hohen Stellenwert in der Diagnostik hat die MRT, weil kaum eine Methode nicht-invasiv so viele Informationen über den Zustand des Herzmuskels liefert. (Agenturfoto)
© iStock/Portra
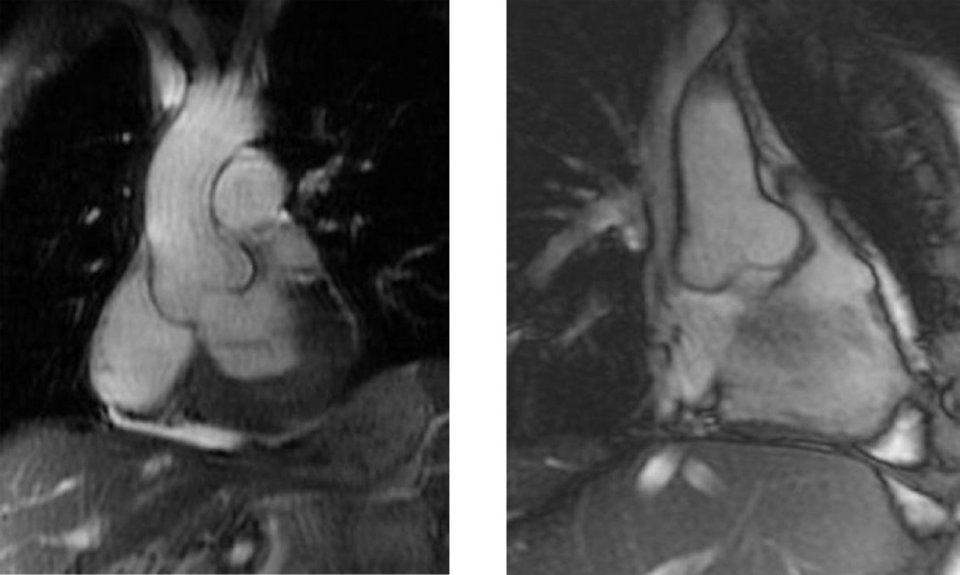
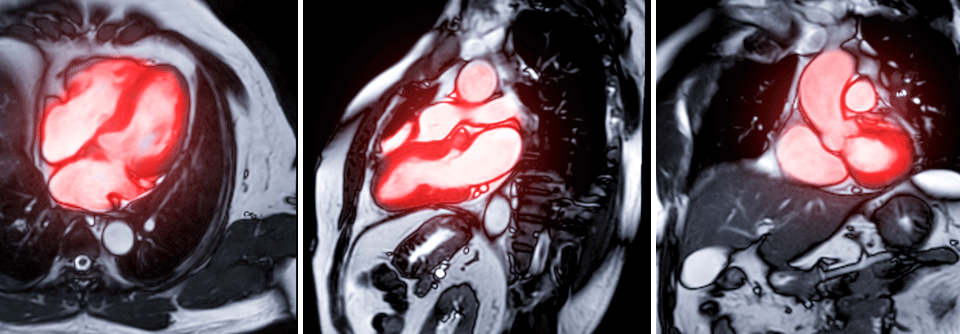
Einen hohen Stellenwert in der Diagnostik hat die MRT, weil kaum eine Methode nicht-invasiv so viele Informationen über den Zustand des Herzmuskels liefert. Das Alleinstellungsmerkmal der Kardio-MRT ist laut Professor Dr. Jeanette Schulz-Menger, Kardiologin der Charité – Universitätsmedizin Berlin, „dass wir mittels kontrastmittelverstärkter oder auch kontrastmittelfreier Techniken in der Lage sind, ins Myokard hineinzuschauen“. Damit lassen sich Funktion und Morphologie darstellen und quantifizieren, z.B. fokale Narben, diffuse Fibrosen oder Ödeme als Zeichen der akuten Schädigung. Mit modernen Analysemethoden kann man darüber hinaus die Akuität des Prozesses ermitteln.
Viel Fett im Herzen spricht für einen Morbus Fabry
Außerdem erlaubt die MRT, die Krankheitsaktivität zu beurteilen, und zunehmend gelingt es, die Patienten nach ihrem Risiko zu stratifizieren. Im von den amerikanischen National Institutes of Health finanzierten HCMR-Register untersuchen Forscher bei 2700 Patienten mit hypertropher Kardiomyopathie Prognosemarker für diese Erkrankung. Es soll helfen, neue therapeutische Strategien zu entwickeln und die Behandlung besser zu steuern.
In der europäischen Herzinsuffizienzleitlinie von 2016 wird die MRT zur kausalen Differenzialdiagnose empfohlen. Findet sich im T1-Mapping viel Fett im Herzen, spricht das für einen M. Fabry, während vermehrtes extrazelluläres Volumen (ECV) auf eine Amyloidose schließen lässt. „Mittlerweile wissen wir, dass die Quantifizierung des ECV, also das Mapping vor und nach Kontrastmittelapplikation, auch prognostische Implikationen hat“, erklärte Prof. Schulze-Menger. Bei Patienten mit Kardiomyopathie infolge Transthyretin-Amyloidose beispielsweise lässt es sich zur Therapiekontrolle nutzen: Geht das ECV unter Behandlung deutlich zurück, darf der Patient mit einem längeren Überleben rechnen.
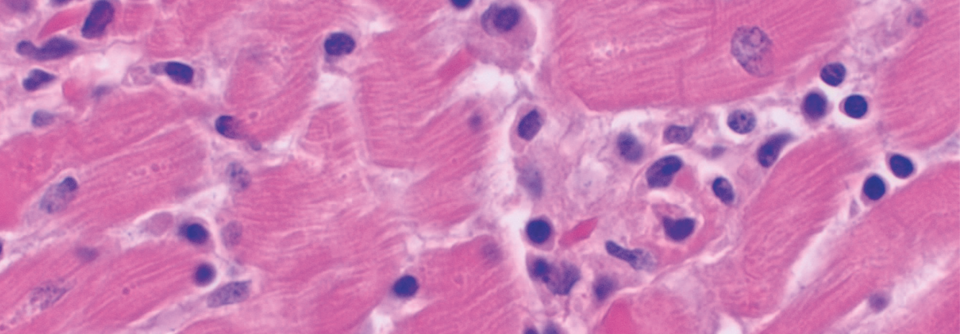
Relevanz und therapeutische Konsequenz der Myokardbiopsie sehen viele Kardiologen kritisch, so die Erfahrung von Professor Dr. Karin Klingel, Kardiopathologin vom Universitätsklinikum Tübingen. Doch bildet die Endomyokardbiopsie den Goldstandard zur Diagnose akuter und chronischer inflammatorischer Herzerkrankungen, zumal sie häufig die einzige Chance bietet, die zugrunde liegende Ätiologie zu klären. Außerdem kann das Ergebnis sofortige Therapieentscheidungen fordern, wie die Referentin an zwei Fallbeispielen demonstrierte.
Eine 39-jährige Asthmapatientin bekam nach einer Schnittentbindung Husten und Dyspnoe. Im Echo stellten sich diffuse Hypokinesien dar, die Ejektionsfraktion (EF) betrug 25 %. Die Biopsie ergab eine eosinophile Myokarditis. Die umgehend eingeleitete immunsuppressive Therapie „rettete der Patientin wahrscheinlich das Leben“, so Prof. Klingel.
Enteroviren zerstören Myozyten in kürzester Zeit
Die zweite Patientin, 42 Jahre alt, hatte weniger Glück. Wegen eines M. Wegener stand sie unter Rituximab, als sie einen AV-Block mit massiv reduzierter EF entwickelte. Die Rheumatologen behandelten hoch dosiert mit Kortison, doch die kurze Zeit später erfolgte Biopsie zeigte massive Nekrosen und eine fulminante lymphozytäre Myokarditis bei Cocksackievirus-B2-Infektion, welche die Frau das Leben kostete.
Enteroviren, die infizierte Myozyten binnen 24 Stunden zerstören, und Kortison bilden eine lebensbedrohliche Kombination, warnte Prof. Klingel. Die Erreger sprechen aber gut auf Typ-1-Interferone an. Deshalb ist es wichtig, nicht nur zu wissen, dass eine Virusinfektion hinter der Myokarditis steckt, sondern auch, um welches Virus es sich handelt. Im Zweifel klärt das die Biopsie plus Polymerase-Kettenreaktion.
Anders als MRT und Biopsie stellen Labortests bei Myokarditis und Kardiomyopathie „sicher keine Hauptsäule der Diagnostik“ dar, meinte Professor Dr. Ingrid Kindermann, Innere Medizin III, Universitätsklinikum Homburg/Saar. Zumal die Klinik der eigentlichen Entzündung hinterherhinkt und negative Befunde eine chronische Myokarditis nicht sicher ausschließen. Denn die Entzündungsparameter sind praktisch nur im akuten Stadium erhöht. Ähnliches gilt für die Biomarker Troponin T (TnT) und NT-proBNP, die aber zumindest prognostische Aussagen erlauben. Stark erhöhte Werte deuten auf ein hohes Risiko für Herztod oder die Notwendigkeit der Herztransplantation hin.
Die Virusserologie schließlich besitzt keinen Stellenwert, die Treffsicherheit liegt viel zu gering: Oft schlägt sie auf Viren an, die nicht mit denen übereinstimmen, die man im Myokard entdeckt. Das liegt u.a. daran, dass viele Menschen IgG-Antikörper gegen kardiotrope Viren tragen. So sind sieben von zehn Deutschen seropositiv für Parvovirus B19.
Das bedeutet aber nicht, dass das Labor verzichtbar wäre. Ein wichtiges Beispiel: die Tumortherapie mit Checkpointinhibitoren, die das Immunsystem nicht nur gegen den Krebs, sondern auch gegen körpereigene Gewebe scharf stellen kann. Trifft es das Herz, kommt es zu früh einsetzenden, oft fulminant verlaufenden Myokarditiden, die eine rasche Diagnose und Therapie erfordern. TnT findet sich bei diesen Patienten fast immer erhöht, NT-proBNP in zwei Dritteln der Fälle. Unter Checkpointinhibitoren ist die engmaschige Biomarkerkontrolle daher essenzieller Bestandteil des Monitorings.
Quelle: 86. Jahrestagung und Herztage 2020 der DGK (Deutsche Gesellschaft für Kardiologie) – Herz- und Kreislaufforschung; Online-Veranstaltung