Idiopathische Lungenfibrose Das fibrotische Perpetuum anhalten
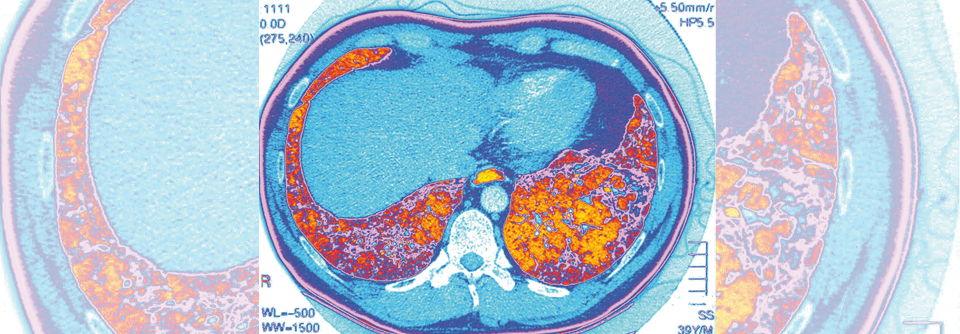
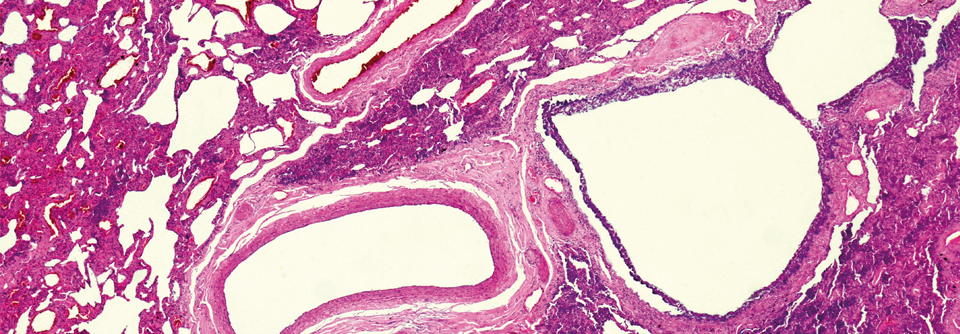 Bei Fibrose proliferiert das Bindegewebe zwischen Alveolen und Blutgefäßen. Das infolgedessen verhärtete und vernarbte Lungengewebe erschwert die Atmung.
© Science Photo Library/Downer, Nigel
Bei Fibrose proliferiert das Bindegewebe zwischen Alveolen und Blutgefäßen. Das infolgedessen verhärtete und vernarbte Lungengewebe erschwert die Atmung.
© Science Photo Library/Downer, Nigel
Für die idiopathische Lungenfibrose (IPF), die aggressivste Form einer interstitiellen Lungenerkrankung, stehen bisher zwei antifibrotische Medikamente zur Verfügung. Sie bremsen die Progredienz, vermögen sie aber nicht zu stoppen, und sind aufgrund ihrer Nebenwirkungen im Einsatz limitiert, betonte Prof. Dr. Malgorzata Wygrecka vom Center for Infection and Genomics of the Lung der Universität Gießen. Um neue Pharmaka entwickeln zu können, ist ein detailiertes Verständnis der pathogenetischen Mechanismen unerlässlich. Doch „das ist schwierig, weil die Mechanismen komplex sind und wir die Patienten praktisch nie zu Beginn ihrer Erkrankung sehen“, sagte die Biochemikerin.
Fibrinsynthese…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.