Nebenwirkungen vorbeugen und Beschwerden medikamentös behandeln
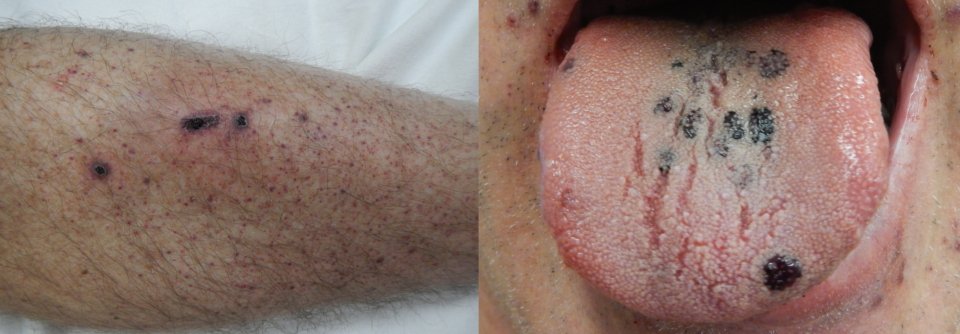 Meist nicht größer als Nadelköpfe – petechiale Blutungen in Gewebe und Organen, ein häufiges Symptom der ITP.
© wikipedia/ James Heilman
Meist nicht größer als Nadelköpfe – petechiale Blutungen in Gewebe und Organen, ein häufiges Symptom der ITP.
© wikipedia/ James Heilman
Leidet ein Tumorpatient unter Blutarmut, kann das an der Behandlung liegen. Bluttransfusionen sind als Gegenmaßnahme zwar prinzipiell denkbar. „Allerdings ist das keine allzu gute Idee“, warnte Professor Dr. Hartmut Link, Onkologe aus Kaiserslautern.1 Sie führen vermehrt zu Komplikationen und verschlechtern die Prognose. Mit einer Ausnahme.
„Nur bei Patienten, die einen Hb-Wert unter 7–8 g/dl aufweisen und bei denen ein schneller Hämoglobinanstieg erforderlich ist – zum Beispiel bei kardialen Beschwerden oder zerebralen Problemen – kann transfundiert werden“, so der Kollege. In allen anderen Fällen solle man zunächst auf einen potenziellen Mangel an Eisen, Vitamin B12 oder Folsäure sowie auf Entzündungen achten und diese entsprechend behandeln. Bei einem Hb von weniger als 8–10 g/dl unter Chemotherapie ggf. auch mit Erythropoetin.
„Ab FN-Risiko von 20 % a priori G-CSF-Prophylaxe“
Ebenfalls ein Risiko für den Behandlungserfolg und das Überleben: die febrile Neutropenie (FN). Denn dann müssen, wie Prof. Link erklärte, Therapiedosen reduziert oder Zyklen verschoben werden. Daher sollte man vor jedem Behandlungszyklus das FN-Risiko analysieren und bei Bedarf eine Prophylaxe mit dem Granulozyten-Kolonie-stimulierenden Faktor G-CSF starten. Zum Beispiel bei Personen mit einer dosisdichten Therapie oder einem hohen Risiko von mindestens 20 %: „Dann wird a priori immer eine G-CSF-Prophylaxe empfohlen“, sagte Prof. Link. Liege das Risiko unter 10 %, braucht es dies nicht.
Bei mittlerem Risiko kämen zusätzliche individuelle Faktoren ins Spiel, wie Alter, Komorbiditäten oder Performancestatus. Auch wer schon einmal eine Neutropeniekomplikation hatte, sollte im nächsten Zyklus eine Prophylaxe erhalten.
Die Hämatotoxizität ist zudem bei den PARP- und CDK4-/6-Inhibitoren relevant. „Anders als bei der Chemotherapie tritt diese jedoch schon früh unter der Behandlung auf – nämlich in den ersten drei Monaten“, erklärte Privatdozentin Dr. Georgia Schilling, Asklepios Nordseeklinik in Westerland/Sylt.2 Sie bessere sich i.d.R. im Verlauf wieder, ohne dass man dafür einen Wachstumsfaktor nutzen müsse.
Konkret bekommen unter PARP-Inhibitoren im ersten Monat bis zu 61 % der Behandelten eine Thrombozytopenie. Anämie und Neutropenie manifestieren sich meist zwischen dem zweiten und dritten Therapiemonat und betreffen 37–50 % bzw. 18–30 % der Patienten. Dabei scheinen die Raten unter Niraparib am größten zu sein, auch hinsichtlich der Grad-4-Toxizität. „Daher sollten bei Niraparib initial wöchentlich Blutbildkontrollen erfolgen, ab der sechsten Woche monatlich“, lautete der Rat der Ärztin.
Bei den CDK4-/6-Hemmern stelle die Neutropenie die Haupthämatotoxizität dar, so Dr. Schilling. Sie trete schon in den ersten beiden Zyklen auf. Unter Palbociclib müssen sogar fast alle damit rechnen. Daher gehöre in den ersten beiden Therapierunden alle 14 Tage ein Monitoring dazu. Danach könne man die Abstände auf monatliche Intervalle erweitern. Wichtig zu wissen: Die Neutropenierate nehme von Zyklus zu Zyklus ab, eine kumulative Toxizität gebe es keine.
Ergänzen sollte man außerdem zwei EKG im ersten Zyklus sowie ein weiteres zu Beginn des zweiten. Denn vor allem Ribociclib könne die QT-Zeit verlängern. Das habe auch Einfluss auf den Einsatz von Antidepressiva (nicht gleichzeitig geben!). Es gilt natürlich Substanzen zu vermeiden, die ebenfalls die QT-Zeit beeinflussen und/oder Torsades, die Pointes-Tachykardien auslösen. Im Detail könne man das Thema bald in der aktualisierten Leitlinie „Psychoonkologie“ nachlesen.
Eine andere Nebenwirkung der beiden Substanzklassen ist die gastrointestinale Toxizität – bei den PARP-Inhibitoren vor allem Übelkeit, die drei Viertel entwickeln, jedoch nur bei 3–4 % Grad 3 erreicht. In diesem Zusammenhang wies Dr. Schilling darauf hin, dass sich hier die Empfehlungen zwischen den Leitlinien unterscheiden: Während das NCCN in ihren Guidelines Olaparib, Niraparib und Rucaparib als moderat bis stark emetogen einschätzt, gelte Olaparib bei uns als Substanz mit niedrigem emetogenem Potenzial.
In den USA empfehle man die Einnahme eines 5-HT3-Rezeptorantagonisten 30 Minuten vor der Einnahme eines PARP-Inhibitors und nicht auf nüchternen Magen. Niraparib werde nur einmal täglich zur Nacht gegeben. „Dann wird diese Nebenwirkung sozusagen verschlafen“, sagte Dr. Schilling. Bei „Durchbruch“-Übelkeit könne man bei Bedarf eine zweite Substanzklasse hinzufügen, in der Zweitlinie seien alle Antiemetika möglich – individuell nach Patient und Therapiesituation. Aufpassen müsse man hinsichtlich Olaparib: Aufgrund der CYP3A4-Interaktion dürfe man keine NK1-Rezeptorantagonisten einsetzen.
Bei den CDK4-/6-Inhibitoren trete die GI-Toxizität normalerweise im ersten Zyklus auf und nehme dann nach dem vierten bis fünften ab. „Unter Palbociclib und Ribociclib sind die Symptome in der Regel geringgradig“, so die Referentin. Abemaciclib löse Beschwerden mit 73–90 % häufiger aus, wenn auch nur bei 3 % der Behandelten schwerer als Grad 3. „Man sollte aber immer bedenken, dass gerade Übelkeit für den Patienten eine schwerwiegende Nebenwirkung ist, auch wenn sie nur niedriggradig ist.“
Ein Aspekt, der ebenfalls Anita Margulies wichtig war.3 Die Fachexpertin für Onkologiepflege aus Zürich betonte, dass viele Patienten dächten, diese Nebenwirkung gehöre dazu und zeige, dass die Behandlung wirkt. Sie sollten jedoch wissen, dass ihre Therapie nicht mit Übelkeit und Erbrechen einhergehen muss. Ziel aller Leitlinien sei es, akute Übelkeit und Erbrechen zu vermeiden.
„Welche Medikamente dafür zum Einsatz kommen, orientiert sich immer an der Therapie mit dem höchsten emetogenen Potenzial“, so Margulies. Standardmäßig verwende man bei hohem Risiko sowie unter Carboplatin eine Kombi aus 5-HT3-Rezeptorantagonist plus Dexamethason und NK1-Rezeptorantagonist. Neu hinzugekommen sei die Option, diese bei hohem Emesispotenzial und bei Bedarf durch Olanzapin zu ergänzen, erklärte sie. Allerdings könnte der Beipackzettel die Patienten verschrecken, da der Wirkstoff normalerweise bei Schizophrenie und akuten manischen Episoden einer bipolaren Störung eingesetzt werde. „Man muss gut erläutern, warum das Medikament geeignet ist“, gab sie zu bedenken.
Nummer des Onkologen gehört zum Arztbrief dazu
Als GI-toxisch weniger problematisch stufte Margulies die Checkpoint-Inhibitoren ein. Diese seien nur minimal emetogen und erforderten keine regelmäßige Antiemese. Ohne Nebenwirkungen geht es aber auch bei diesen nicht, wie Dr. Kathrin Heinrich vom Klinikum der Universität München deutlich machte.4
Aufgrund ihrer Wirkweise könne theoretisch jedes Symptom, das unter der Checkpoint-Inhibition neu auftrete, eine immunvermittelte Reaktion sein. „Die meisten dieser unerwünschten Effekte sind durch eine gründliche körperliche Untersuchung, gezielte Anamnese und Laborparameter wie Leber- und Nierenfunktionswerte, Blutbild und Schilddrüsenhormone frühzeitig erkennbar“, sagte Dr. Heinrich.
Außerdem sei es essenziell, die Patienten über die Wirkweise und das potenzielle Nebenwirkungsspektrum ihrer Therapie aufzuklären. Genauso müssten Ärzte geschult werden. Für Hausärzte seien im Arztbrief ein Hinweis auf die Verwendung eines Checkpoint-Inhibitors und die Notfallnummer des betreuenden Onkologen hilfreich.
Ob Komplikationen auftreten, hängt auch vom eingesetzten Medikament ab. CTLA-4-Antikörper wie Ipilimumab verursachen nach Aussage der Kollegin bei fast 72 % der Behandelten Nebeneffekte, mit den PD(-L)1-Hemmern seien zwei Drittel betroffen – im Schnitt in den ersten zwölf Wochen nach Therapiebeginn. Kombiniere man beide, falle das Risiko am größten aus. Daher sollte man vor jedem Zyklus eine Kontrolle machen, bei Kombination mit einer Chemotherapie auch wöchentlich ein Blutbild.
Nach Therapieende zwei, drei Monate weiter beobachten
„Bei leichten Nebenwirkungen kann man die Therapie meist unter engmaschiger Kontrolle fortführen“, sagte Dr. Heinrich. Bei höhergradigen Effekten müsse man pausieren, bis wieder Grad 1 erreicht wird, oder sogar abbrechen. Die meisten Komplikationen lassen sich mit Steroiden gut behandeln, diese müsse man aber über vier bis sechs Wochen wieder ausschleichen, damit die Nebenwirkungen beim Absetzen nicht sofort wieder aufflammten. Bei schwersten Problemen sei das endgültige Absetzen des Medikaments in der Regel unumgänglich.
Auch nach dem Abklingen der Beschwerden scheint eine erneute Behandlung nicht unmöglich. Das müsse man aber nach eingehender Risiko-Nutzen-Abwägung mit dem Patienten besprechen, so die Referentin. In Studien kam es bei bis zu 55 % der Teilnehmer nach Reexposition zu der gleichen oder einer anderen immunvermittelten Reaktion. Wichtig: Nebenwirkungen können auch nach dem Ende der Therapie auftreten. Daher empfahl die Ärztin, die Patienten im Anschluss noch zwei bis drei Monate im Auge zu behalten.
Quellen:
1. Link H. AGSMO-Jahreskongress 2021 (virtuell); Knochenmarktoxizität/Infektionen
2. Schilling G. A. a. O.; Neue Substanzen, neue Toxizitäten
3. Margulies A. A. a. O.; GI-Toxizität/Antiemese
4. Heinrich K. A. a. O.; Immunvermittelte Toxizitäten
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).