Pathogenese bleibt komplex
 Zur Differenzierung der Urtikaria wurde ein neuer Endotyp definiert - die chronische autoimmune spontane Urtikaria (aiCSU).
© Jürgen Fälchle – stock.adobe.com
Zur Differenzierung der Urtikaria wurde ein neuer Endotyp definiert - die chronische autoimmune spontane Urtikaria (aiCSU).
© Jürgen Fälchle – stock.adobe.com
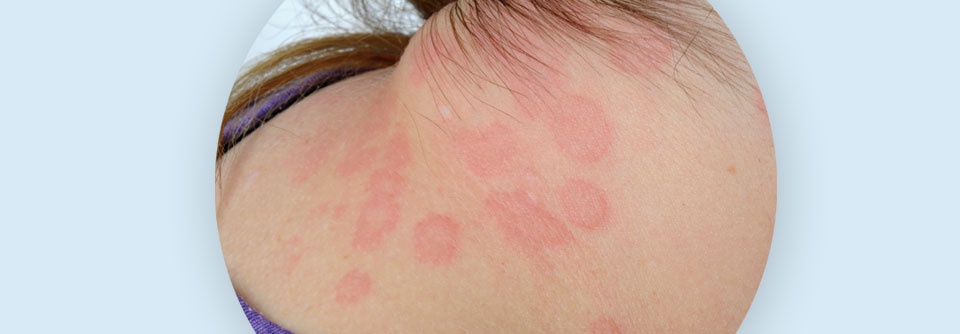
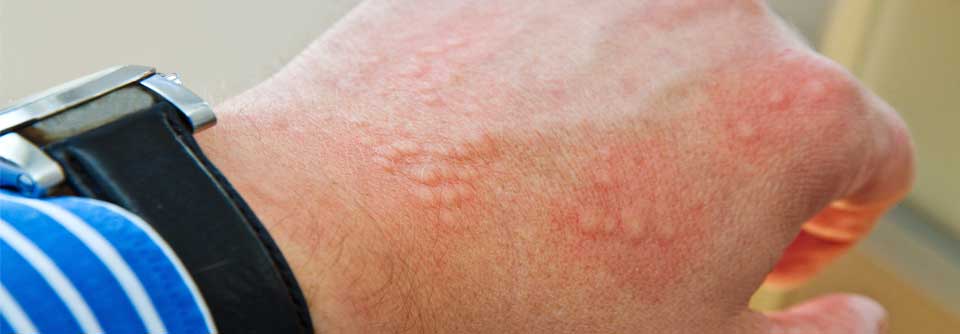
Seit Jahren scheint die Prävalenz der chronischen Urtikaria zuzunehmen. Dennoch ist hinsichtlich der Pathogenese vieles immer noch unklar. Das schränkt nicht nur Therapieoptionen ein, sondern erschwert auch die Beratung der Patienten, die z.B. auf die Standardtherapien nicht ansprechen. Neue Erkenntnisse könnten diese Situation verbessern.
Urtikaria
Degranulierte Mastzellen spielen bei chronischer spontaner Urtikaria (CSU) eine zentrale Rolle. Sie können über IgE, aber auch über verschiedene andere Mechanismen, Moleküle und Rezeptoren aktiviert werden. Dazu zählen insbesondere autoallergische und autoimmune Signalwege.
Neu definiert als einen Endotyp* der CSU hat man die chronische autoimmune spontane Urtikaria (aiCSU). Sie zeichnet sich durch die Anwesenheit von IgG- oder IgM-Autoantikörpern gegen IgE oder dessen Rezeptor FcεRI aus. Der Antikörper bindet das Ziel und die folgende Aktivierung führt zur Degranulation der Mastzellen. Patienten mit aiCSU leiden häufig auch an anderen Autoimmunkrankheiten wie Hashimoto-Thyreoiditis. Es gibt auch eine autoallergische CSU (aaCSU). Ausgelöst wird diese durch IgE-Antikörper gegen verschiedene Autoantigene wie Thyreoperoxidase, Thyreoglobulin oder Gewebethromboplastin (Faktor III), Doppelstrang-DNA oder Interleukin-24.
Zudem versteht man mittlerweile auch die Rolle von Basophilen und Eosinophilen bei der CSU immer besser. Bei einem Teil der Patienten wurde eine ausgeprägte Basopenie beobachtet, u.a. verbunden mit verminderter IgE-Rezeptor-Expression und TPO-Autoantikörpern. Diese Patienten zeigen eine hohe Krankheitsaktivität, ebenso wie die Patienten, bei denen eine Eosinopenie als pathogenetisch relevant festgestellt wurde. Bei einigen Patienten wird auch eine gewisse genetische Prädisposition vermutet.
Histamin und IgE gelten weiterhin als zentrale Faktoren, es sind inzwischen aber weitere Moleküle hinzugekommen. Das ist insofern relevant, da bei manchen Patienten Antihistaminika und Anti-IgE-Behandlungen keinen Erfolg bringen.
Neben Faktoren der Gerinnungskaskade, die eine Mastzellreaktion triggern können, finden sich mehr und mehr Beweise für die Beteiligung von verschiedenen Alarminen, IFN-g, IFN-a, IL-17A sowie eine hemmende Wirkung von IL-35. Der plättchenaktivierende Faktor (PAF) triggert nachweislich Quaddeln und Schübe auch unabhängig von Histamin. Zudem wurden in Studien bei Patienten mit CSU erhöhte Spiegel von VEGF, IL-6, Matrixmetalloprotease-9 und Hitzeschockproteinen nachgewiesen.
Eine Möglichkeit, um Mastzellen – insbesondere jene in der Haut – zu aktivieren, besteht außerdem über den mastzellspezifischen G-Protein-gekoppelten Rezeptor MRGPRX2. Dieser reagiert auf das Major Basic Protein und die Peroxidase der Eosinophilen sowie auf die Substanz P. Es ließ sich zeigen, dass der Rezeptor bei Patienten mit CSU hochreguliert ist. Die Beteiligung des Neurotransmitters Substanz P könnte u.a. die Stressassoziation der CSU erklären.
Auf welchem Weg virale Infektionen Exazerbationen der CSU provozieren, bleibt auf molekularer Ebene weiterhin unklar. Eine aktuelle Studie hat gezeigt, dass die Urtikaria die zweithäufigste kutane Manifestation einer COVID-19-Infektion darstellt. COVID-19 kann auch eine chronische Urtikaria zur Exazerbation bringen.
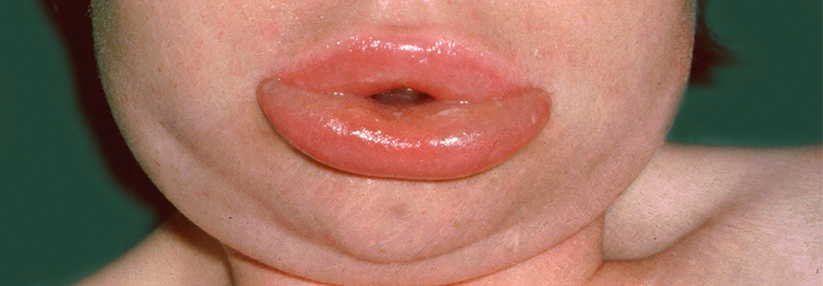
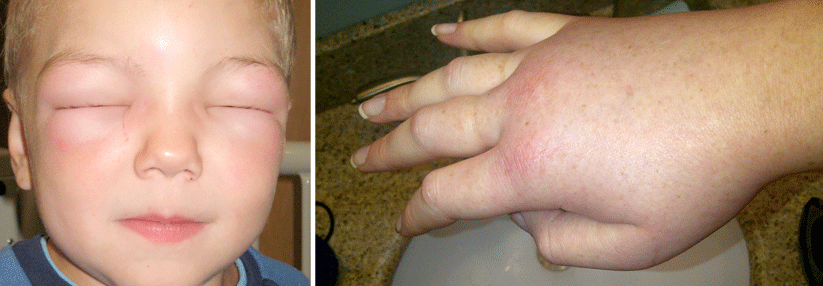
Angioödem
Bei einem Angioödem treffen eine vorübergehend lokal erhöhte vaskuläre Permeabilität und Plasma-Leckagen in tiefere Schichten von Dermis und Subkutis zusammen. Vermittelt wird diese entweder durch Histamin, z.B. bei Patienten mit Urtikaria oder durch Bradykinin (BK). Beide ähneln sich, das BK-vermittelte Angioödem, z.B. bei Patienten mit hereditärem Angioödem (HAE), zeigt jedoch klinisch in der Regel eine langsamere Progression zum vollen Schweregrad und dauert länger an, wenn es unbehandelt bleibt.
Die Unterscheidung zwischen beiden Formen ist ausschlaggebend für die Therapie. Antihistaminika, Omalizumab und Glukokortikoide, die bei Histamin-vermitteltem Angioödem wirksam sind, helfen Patienten mit BK-vermitteltem Angioödem nicht. Allerdings fehlen Biomarker, die Art des Angioödems sowie Attacken oder deren Schweregrad vorhersagen könnten. Als Kandidaten gelten derzeit Tie-2 (für HAE), Fibroblasten-Aktivierungsprotein-a und gewebespezifischer Plasminogenaktivator (Angioödem allgemein) sowie sE-Selektin und Ang-2 (BK-vermittelte Angioödeme).
Die vorherrschende Ursache eines BK-vermittelten Angioödems ist eine erworbene oder autosomal dominant vererbte C1-Inhibitor-Defizienz, die zu einer erhöhten Plasmakonzentration von Bradykinin führt. Es muss allerdings davon ausgegangen werden, dass man noch nicht alle Mutationen kennt, die zu einem qualitativen oder quantitativen C1-Inhibitor-Defizit führen. Ein erworbenes C1-Inhibitor-Defizit entsteht z.B. bei lymphoproliferativen oder Autoimmunerkrankungen oder durch die Einnahme von ACE-Hemmern.
Es gibt zusätzlich Situationen, bei denen kein C1-Inhibitor-Defizit vorliegt und in denen andere Ursachen im Bereich der Kontaktsystem-Dysregulation oder vaskulären endothelialen Dysfunktion infrage kommen. Es wäre von großem Interesse, zugrunde liegende Mutationen zu identifizieren, schreiben die Autoren.
Neue Wege der Therapie
Es besteht weiterhin ein großer Bedarf an neuen krankheitsmodifizierenden Medikamenten. Neue pathogenetische Konzepte wie Autoimmunität oder Autoallergie bei der Urtikaria eröffnen Ansatzpunkte für maßgeschneiderte Therapien, von denen Patienten profitieren könnten, die mit vorhandenen Therapieoptionen keine Krankheitskontrolle erreichen: Etwa 60 % der Patienten sprechen auf die Standardtherapie mit Antihistaminika nicht an. Eine Dosissteigerung hilft auch nur zwei von drei Non-Respondern. Und unter Omalizumab bleibt mehr als ein Drittel der Patienten symptomatisch. Auch wenn die neuen Therapien auf sich warten lassen: Anhand der neuen Erkenntnisse lassen sich nicht nur mögliche Triggerfaktoren identifizieren. Sie helfen auch dabei, den Patienten ihre Situation genauer zu erklären und sie dabei zu unterstützen, besser damit umzugehen.
Spezifischere Therapien wie C1-Inhibitorkonzentrate und BK-Rezeptorantagonisten könnten zudem akuten Attacken beim hereditären Angioödem vorbeugen. Auch in diesem Bereich sind derzeit Medikamente in Entwicklung.
*Subgruppe mit charakteristischem pathogenetisch relevantem Merkmal, im Gegensatz zum Phänotyp bei dem das typische Merkmal keinen Einfluss auf den Mechanismus haben muss.
Quelle: Konstantinou GN et al. J Allergy Clin Immunol Pract 2023; 11: 94-106; DOI: 10.1016/j.japi.2022.11.006
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).