Studie deutet auf Nutzen von Antikörper zur Schmerzlinderung
 Primärer Endpunkt der Studie war die Reduktion der täglichen durchschnittlichen Schmerzintensität.
© iStock/sompong_tom
Primärer Endpunkt der Studie war die Reduktion der täglichen durchschnittlichen Schmerzintensität.
© iStock/sompong_tom
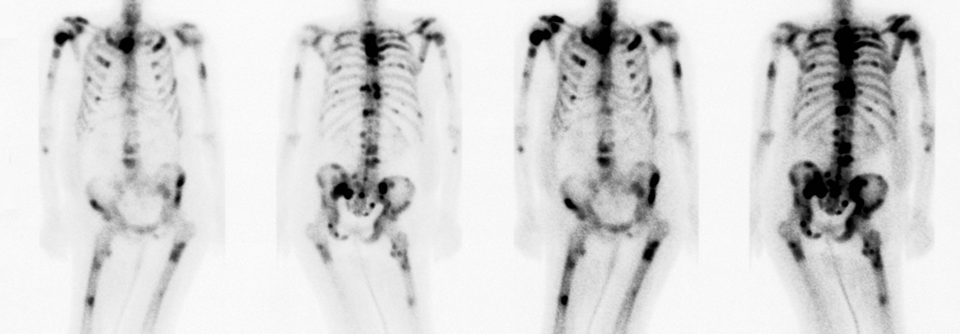
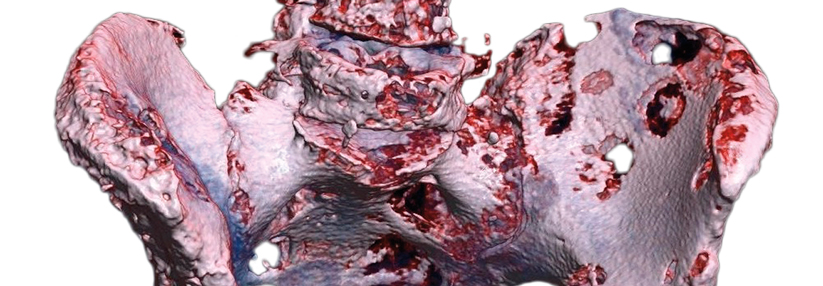
Professor Dr. Marie Fallon, Edinburgh Palliative and Supportive Care Group, stellte das Late-Breaking-Abstract der doppelblinden Studie vor. An ihr nahmen 145 Patienten, die trotz optimierter Opioid-Gabe hauptsächlich durch Knochenmetastasen ausgelöste Tumorschmerzen hatten, teil. Ihr Schmerzintensitäts-Score auf einer Skala von 0 bis 10 betrug mindestens 5. Die Diagnose der Knochenmetastasen lag im Schnitt etwa zwei Jahre zurück.
Die Patienten erhielten entweder 20 mg Tanezumab s.c. oder Placebo s.c. alle 8 Wochen für insgesamt 24 Wochen zusätzlich zur gewohnten Opioid-Therapie. In der Kontrolle unterzogen sich 60,3 % zudem einer antineoplastischen Therapie, im Prüfarm 66,7 %.
Studienabbrüche unter Placebo häufiger
Primärer Endpunkt der Studie war die Reduktion der täglichen durchschnittlichen Schmerzintensität an der Index-Knochenmetastase von Studienbeginn bis Woche 8. Tanezumab reduzierte die durchschnittliche Schmerzintensität in Woche 8 deutlich stärker als Placebo (-2,03 vs. -1,25; p = 0,0381). Auch in Woche 1, 2, 4 und 6 wurde der Schmerz durch den Antikörper signifikant stärker gelindert. Nach Woche 8 allerdings sei der Unterschied in der Schmerzreduktion nicht mehr signifikant gewesen, erläuterte Prof. Fallon.
Unerwünschte Ereignisse waren unter Tanezumab häufiger, Studienabbrüche hingegen unter Placebo. Bei zwei Patienten kam es im Prüfarm zu einer pathologischen Fraktur in der Nähe der Knochenmetastasen. Insgesamt sah die Expertin Potenzial für Tanezumab zur Schmerzreduktion bei Knochenmetastasen. Zu beachten sei jedoch, dass nach Woche 8 keine signifikante Wirksamkeit auftrat. Tanezumab ist in der EU nicht zugelassen.
Quellen:
Fallon M et al. ESMO Congress 2021; Abstract LBA62
ESMO Congress 2021
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).