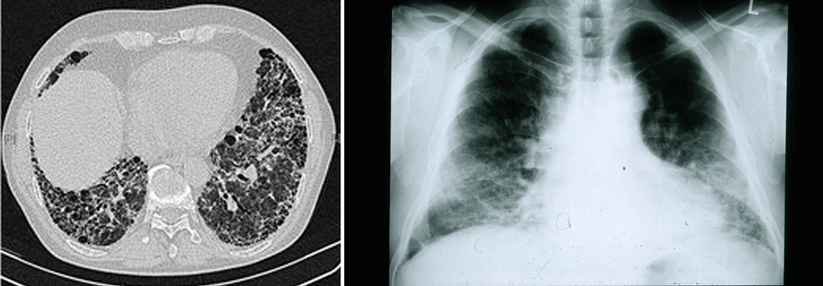
Lungenkarzinome Verschiedene Antikörper-Wirkstoff-Konjugate könnten bald die Therapie des NSCLC verändern
 Antikörper-Wirkstoff-Konjugate werden derzeit für die Therapie des NSCLC entwickelt.
© Crystal light – stock.adobe.com
Antikörper-Wirkstoff-Konjugate werden derzeit für die Therapie des NSCLC entwickelt.
© Crystal light – stock.adobe.com
Die "smarte Chemotherapie“ nannte Dr. Sabine Schmid, Inselspital, Universität Bern, das Konzept der Antikörper-Wirkstoff-Konjugate (ADC). Mit dem Baukasten aus drei unterschiedlichen Elementen – Antikörper, Payload und Linker – lassen sich verschiedene Zielstrukturen auf Lungenkarzinomen nutzen, um Zytostatika in die Tumorzellen zu bringen. Trastuzumab-Deruxtecan (T-DXd) beispielweise dockt an den HER2-Rezeptor an, wird internalisiert und setzt einen Topoisomerase-I-Inhibitor als Payload frei. Beim NSCLC ist eine HER2-Mutation mit 2,3 % häufiger als die in Mammakarzinomen überwiegend vorliegende HER2-Amplifikation oder Überexpression, erläuterte Dr. Schmid.
In der DESTINY-Lung01-Studie…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.