Misslungenes Eiweiß-Origami Was man über Amyloidosen wissen sollte
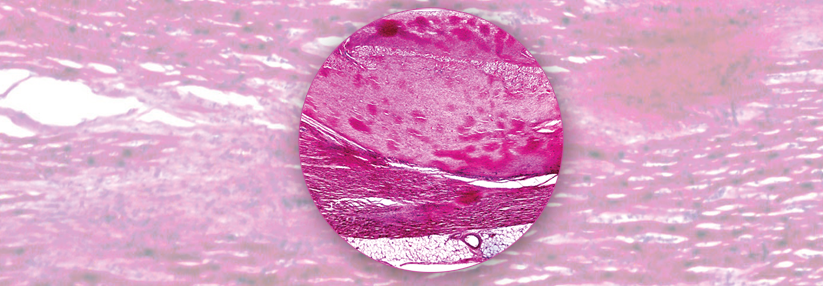
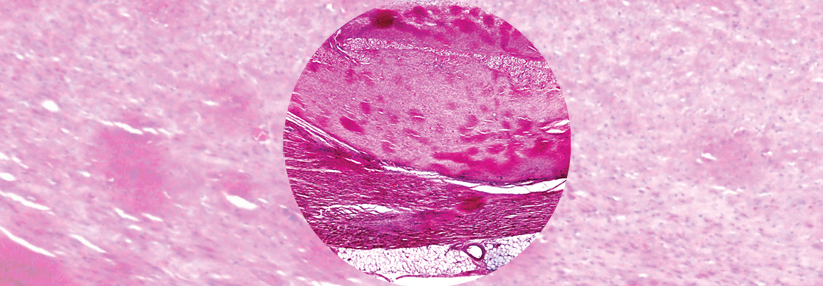
 Letzten Endes führten die Exzisionsbiopsien schließlich zur Diagnose einer AL-Amyloidose.
© Juan Gärtner – stock.adobe.com
Letzten Endes führten die Exzisionsbiopsien schließlich zur Diagnose einer AL-Amyloidose.
© Juan Gärtner – stock.adobe.com
Die Bezeichnung Amyloidose fasst eine Reihe sehr heterogener Multisystemerkrankungen in einem Begriff zusammen. Allen gemeinsam ist die Bildung fehlgefalteter Proteine, sogenannter Amyloide, die sich in den Organen ablagern und deren Funktion stören, schreibt Dr. Elisabeth Blüthner von der Charité – Universitätsmedizin Berlin. In Abhängigkeit vom verursachenden Eiweiß entstehen die verschiedensten klinischen Erscheinungsbilder. Bislang sind über 40 amyloide Proteine bekannt, die sich nur anhand einer Biopsie voneinander unterscheiden lassen. Die häufigsten Formen sind die Leichtketten-, die Serumamyloid-A- und die Transthyretin-Amyloidose (AL-, AA- bzw. ATTR-Amyloidose).
Leichtketten-Amylo…
Bitte geben Sie Ihren Benutzernamen und Ihr Passwort ein, um sich an der Website anzumelden.