Chagas-Krankheit Wie sich die Infektionskrankheit in den Griff bekommen lässt
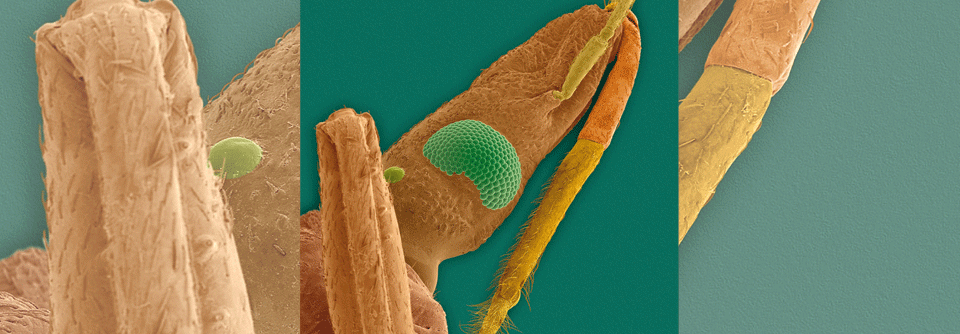 Die übertragenden Wanzen stechen besonders gerne in die Lippen und heißen daher auch kissing bugs.
© Science Photo Library/ DENNIS KUNKEL MICROSCOPY
Die übertragenden Wanzen stechen besonders gerne in die Lippen und heißen daher auch kissing bugs.
© Science Photo Library/ DENNIS KUNKEL MICROSCOPY
Ausgelöst wird die Chagas-Krankheit durch das Protozoon Trypanosoma cruzi. Als Reservoir dienen neben dem Menschen auch viele Wild- und Haustiere, schreiben PD Dr. Michael
Pritsch von der LMU München und Kollegen. Die Erkrankung ist in 21 lateinamerikanischen Ländern endemisch. Dort wird sie durch blutsaugende Raubwanzen übertragen, die sich in Mauerritzen verstecken und bei ihrem Stich trypanosomenhaltigen Kot absetzen. Diesen reibt sich das Opfer beim Kratzen in die Stichwunde oder in Augen-, Nasen- und Mundschleimhaut.
Inzwischen steigt die Zahl von Infizierten in nicht-endemischen Gebieten. Eine immer größere Rolle spielt dabei nicht-vektorielle Übertragung. So können die Protozoen auch durch Blutkontakt verbreitet werden, etwa über Transfusionen, Transplantationen, Laborunfälle oder das Teilen von Nadeln. Mit Wanzenkot verunreinigte Lebensmittel kommen als Quelle ebenfalls in Betracht. Zudem können sich Kinder bei ihren infizierten Müttern anstecken. Auch eine Transmission während der Schwangerschaft oder Geburt ist möglich.
Akutes Stadium bleibt oft unbemerkt
An der Inokulationsstelle dringen die Trypanosomen in den Körper ein. Dabei bildet sich oft eine zumeist schmerzlose gerötete Schwellung, die auch als Chagom bezeichnet wird. Über die Blutbahn gelangen die Parasiten in diverse Organe. Das akute Stadium dauert ein bis drei Monate und wird aufgrund der nur leichten oder unspezifischen Beschwerden vielfach nicht bemerkt. Aber auch ein asymptomatischer oder schwerer Akutverlauf ist möglich. Letzterer manifestiert sich häufig mit Fieber, Lymphadenitis oder Leber- und Milzschwellung. Diese Symptome bilden sich meist von selbst zurück, nur selten kommt es zu einer Myokarditis oder Meningoenzephalitis.
In der chronischen Phase ziehen sich die Trypanosomen in die Organgewebe zurück (z.B. Myokard). Die Parasitämie ist, anders als in der Akutphase, nur noch leicht ausgeprägt oder gar nicht vorhanden. Das symptomfreie Latenzstadium kann Jahre bis Jahrzehnte anhalten. Ein Drittel der Patienten entwickelt eine myokardiale Funktionsstörung, bei etwa 10 % ist der Verdauungstrakt beteiligt. Auch neurologische oder kombinierte Manifestationen kommen vor. Die Organschäden sind potenziell lebensbedrohlich. Eine Reaktivierung der Infektion mit erneuter Parasitämie und hoher Mortalität droht vor allem bei immunsupprimierten Patienten (z.B. HIV-Infektion).
Wer sollte auf T. cruzi gescreent werden?
- Empfohlen wird das Screening laut neuer Leitlinie für Schwangere, gebärfähige Frauen, Blutspender sowie Organspender bzw. -empfänger, die aus endemischen Gebieten stammen oder deren Mütter aus endemischen Gebieten kommen und einen positiven oder unbekannten Status bzgl. einer Chagas-Erkrankung haben.
- Nahegelegt wird das Screening für den gleichen Personenkreis, wenn die Betroffenen unter einer Immundefizienz leiden oder ein erhöhtes Risiko für eine Immundefizienz haben.
- Für den Einzelfall angeraten wird das Screening bei asymptomatischen Personen nach langfristigem Aufenthalt in endemischen Gebieten abhängig vom Infektionsrisiko. Gleiches gilt für alle nicht-schwangeren, nicht-gebärfähigen Frauen, Männer und Kinder, die aus endemischen Gebieten stammen oder deren Mütter aus endemischen Gebieten kommen und einen positiven oder unbekannten Chagas-Status haben.
Leitlinie „Handlungsempfehlungen zu Screening, Diagnose, Behandlung und klinischem Management der Chagas-Krankheit in Deutschland“; www.awmf.org, Register-Nr. 042-009
Die Gewebeschäden werden durch die Trypanosomen selbst oder durch die gegen diese gerichtete Immunantwort ausgelöst. Im chronischen Stadium kann es autoreaktive Prozesse geben, obwohl sich keine Protozoen mehr nachweisen lassen. Klinische Relevanz hat vor allem die dilatative Kardiomyopathie, die sich oft mit einem Aneurysma an der Herzspitze manifestiert. Auch mit Thromboembolien und schweren Rhythmusstörungen bis hin zum plötzlichen Herztod muss man rechnen. An Ösophagus und Kolon sind Megabildungen möglich, die mit einem retrosternalen Druckgefühl, Dysphagie und chronischer Obstipation einhergehen können.
In der Akutphase der Chagas-Erkrankung gelingt ein direkter Parasitennachweis im Blutausstrich. Aufgrund der variablen Parasitämie kann eine wiederholte Blutentnahme nötig sein. Als sensitivere Alternative kommt die Detektion der Erreger-DNA mittels Polymerasekettenreaktion in Betracht. Im chronischen Stadium werden vor allem antikörperbasierte Verfahren eingesetzt, wobei die Diagnose mit zwei unterschiedlichen Verfahren gesichert werden sollte. Bei unklaren Resultaten kann eine PCR weiterhelfen.
Chagas-Krankheit in Deutschland und Europa
Im Jahr 2015 wurde in Europa die Prävalenz der Chagas-Krankheit unter Einwanderern aus Lateinamerika auf 4,2 % geschätzt. Zu der Häufigkeit der Seroprävalenz in Deutschland gibt es bisher nur wenige Untersuchungen. So wurde 1997 in Berlin eine Seroprävalenz von 2 % unter 100 lateinamerikanischen Migranten beschrieben. 2017 waren von 43 Münchner Bürgern bolivianischer Herkunft 9,3 % seropositiv. Eine retrospektive Studie ergab in einem Zeitraum von 2000 bis 2018 bei 5.991 getesteten Personen 81 Chagas-Patienten. Von den 814 Betroffenen, deren Nationalität bekannt war, stammten nur 16 % aus endemischen Gebieten. Nur ein Bruchteil der Erkrankten erhielt eine angemessene Behandlung mit Antiparasitika und die erforderliche Nachsorge, heißt es in der aktuellen Leitlinie.
Leitlinie „Handlungsempfehlungen zu Screening, Diagnose, Behandlung und klinischem Management der Chagas-Krankheit in Deutschland“; www.awmf.org, Register-Nr. 042-009
Zum Nachweis einer Herzbeteiligung eignet sich die Kombination von EKG-Rhythmusstreifen, Röntgenthorax und Echokardiografie. Bei negativem Befund empfehlen die Autoren eine jährliche klinische Kontrolle inkl. EKG. Auch Hinweise auf andere Organbeteiligungen müssen abgeklärt werden.
Therapie läuft über zwei Monate
Die trypanozide Therapie soll die Protozoen eliminieren, Morbidität und Mortalität reduzieren und einer kongenitalen Übertragung vorbeugen. Zur Verfügung stehen Benznidazol (1. Wahl) und Nifurtimox (Zweitlinienbehandlung). Diese können in Deutschland nur off label eingesetzt, von der WHO jedoch mit einem Anforderungsformular kostenlos bezogen werden. Die Therapie dauert in der Regel 60 Tage. Die Wirkstoffe werden von jüngeren Patienten besser vertragen, aber auch bei älteren liegt die nebenwirkungsbedingte Abbruchrate unter 10 %. Wichtig sind regelmäßige Kontrollen, um etwaige Komplikationen rechtzeitig zu erkennen. Die Patienten müssen zudem wissen, dass sie kein Blut spenden dürfen.
Reisende nach Lateinamerika sollten gezielt über die Chagas-Krankheit aufgeklärt werden. Das gilt vor allem für Langzeitaufenthalte sowie Fahrten in meso- und hyperendemische Regionen (z.B. in Bolivien und Peru). Moskitonetze verhindern die vektorielle Übertragung und eine gute Lebensmittelhygiene die orale Transmission. Sollten nach der Rückkehr aus Endemiegebieten verdächtige Symptome auftreten, ist differenzialdiagnostisch an die Chagas-Erkrankung zu denken.
Quelle: Pritsch M et al. Flug u Reisemed 2022; 29: 265-269; doi: 10.1055/a-1961-3415