Pulmonale Hypertonie und Lungenembolie Neues zur CTEPH nach Lungenembolie
 Bei der CTEPH wird wahrscheinlich eine chronische Entzündung durch Zellen des Immunsystems unterhalten.
© Sergey Nivens – stock.adobe.com
Bei der CTEPH wird wahrscheinlich eine chronische Entzündung durch Zellen des Immunsystems unterhalten.
© Sergey Nivens – stock.adobe.com
Persistierende Symptome nach einer Lungenembolie (LE), die durch Lungenfunktionseinschränkung, kardiale Beeinträchtigung und chronisch-thromboembolische Lungenerkrankung (CTEPD) ohne oder mit Lungenhochdruck (CTEPH) entstehen, werden heute unter dem Oberbegriff Post-Lungenembolie-Syndrom (PPES) zusammengefasst. Definitionsgemäß ist von einer CETPD auszugehen, wenn ein LE-Patient nach mindestens drei Monaten therapeutischer Antikoagulation ungematchte Perfusionsdefekte im V/Q-Scan und Anzeichen organisierter fibrotischer Thromben zeigt. Zu letzteren zählen z.B. ringförmige Stenosen, Webs oder Schlitze sowie chronische Totalverschlüsse, erklärte Prof. Dr. Heinrike Wilkens, Kardiologin am Universitätsklinikum Homburg/Saar.
Dass die Thematik spezialisierte Pneumologen und Kardiologen gleichermaßen angeht, machte die Expertin anhand aktueller Studiendaten klar: So wurden z.B. im Rahmen der FOCUS-Studie Spätfolgen nach akuter LE systematisch über 24 Monate nach Diagnosestellung dokumentiert.1 45 % der 1.017 Patienten waren Frauen.
PPES erhöht die Sterblichkeit
Ein PPES wiesen 16 % der Patienten auf, 2,3 % hatten eine CTEPH. Im Vergleich zur auskurierten LE ging das PPES mit einer signifikant erhöhten Sterblichkeit (29 % vs. 5,6 %), einer höheren Rehospitalisierungsrate und schlechterer Lebensqualität einher. 15 der 16 CTEPH-Patienten erfüllten die Studiendefinition eines PPES*. Mit deren Hilfe lassen sich demnach recht zuverlässig Patienten identifizieren, die ein hohes Risiko für eine CTEPH haben.
Bis vor Kurzem gab es kaum Daten dazu, wie viele Patienten eine CTEPD ohne Lungenhochdruck und wie viele eine CTEPH aufweisen. Eine retrospektive Analyse aus Würzburg ergab bei 400 Patienten innerhalb der ersten beiden Jahre nach einer akuten LE für beide Entitäten eine Inzidenz von ca. 5 %.2
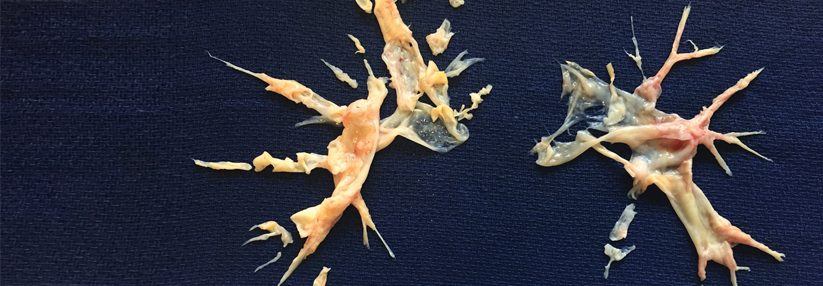
Die unterschiedlichen Therapieoptionen bei CTEPH erfordern eine differenzierte Herangehensweise. Bei proximalen Gefäßverschlüssen rät die europäische Leitlinie zur Endarteriektomie. Sitzt die fibrotische Obstruktion distal, empfiehlt sie die Ballonangioplastie (BPA) und bei mikrovaskulärem Befall die medikamentöse Therapie. Ergebnissen aus der RACE-Studie zufolge lässt sich die Sicherheit der BPA deutlich steigern, wenn die Patienten ein halbes Jahr lang mit Riociguat vorbehandelt werden.3
Eine weitere aktuelle Arbeit4, in der US-Kollegen Einzelzell-RNA-Sequenzierungen an Endarteriektomieresektaten von fünf Patienten durchführten, lässt auf neue Ansätze für die CTEPH-Therapie hoffen, so Prof. Wilkens. In der Gefäßwand fanden sich heterogene Ansammlungen von Makrophagen, T-Zellen und glatten Muskelzellen mit Entzündungs- und Fibrosesignaturen.
Daraus ziehen die Studienautoren den Schluss, dass Makrophagen und T-Zellen eine chronische Entzündung unterhalten, die ihrerseits den Gefäßumbau durch Modulation von Zellen der glatten Muskulatur triggert. Dieses Zusammenspiel könnte sich als Ziel eignen um pharmakologisch einzugreifen, meinte Prof. Wilkens.
Der dringende Bedarf an neuen Therapien steht für die Kollegin außer Frage, zumal Operation und BPA keine Heilung bringen. „Ein 25-Jähriger, der mit einer CTEPH zu uns kommt, hat mit Glück noch 60 Jahre mit dem Krankheitsbild zu leben – da wäre es gut, wenn wir gezieltere Therapieoptionen hätten oder besser noch solche, die verhindern, dass es überhaupt zur CTEPH kommt.“
Weniger Thromben unter Vitamin-K-Antagonisten
Dass es möglicherweise keine gute Idee ist, CTEPH-Patienten mit einem DOAK zu antikoagulieren, deutet eine retrospektive Studie aus San Diego mit 405 Teilnehmern an.5 Die Wahrscheinlichkeit, im Operationspräparat frische Thromben zu entdecken, war bei Patienten unter DOAK-Therapie 2,34-fach höher als bei denjenigen, die Vitamin-K-Antagonisten bekamen. „Wir wissen nicht genau, welche pathophysiologische Bedeutung das hat“, räumte Prof. Wilkens ein und forderte weitere Studien zur Sicherheit und Wirksamkeit von DOAK bei CTEPH.
Quelle: Kongressbericht 63. Kongress der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin
* anhaltende Einschränkung oder Verschlechterung klinischer, funktioneller, biochemischer und bildgebender Parameter
1. Valerio L et al. Eur Heart J 2022; 43: 3387-3398; DOI: 10.1093/eurheartj/ehac206
2. Held M et al. Respir Med 2023; 210: 107177; DOI: 10.1016/j.rmed.2023.107177
3. Jaïs X et al. Lancet Respir Med 2022; 10: 961-971; DOI: 10.1016/S2213-2600(22)00214-4
4. Viswanathan G et al. Am J Respir Crit Care Med 2023; DOI: 10.1164/rccm.202203-0441OC
5. Jeong I et al. Pulmonary Circulation 2022; 12: e12110; DOI: 10.1002/pul2.12110