IgA-Nephropathie Wenn sich Antikörper in die Niere verirren
 Zur Therapie der IgA-Nephropathie stehen viele Optionen zur Verfügung.
© Chutima – stock.adobe.com
Zur Therapie der IgA-Nephropathie stehen viele Optionen zur Verfügung.
© Chutima – stock.adobe.com
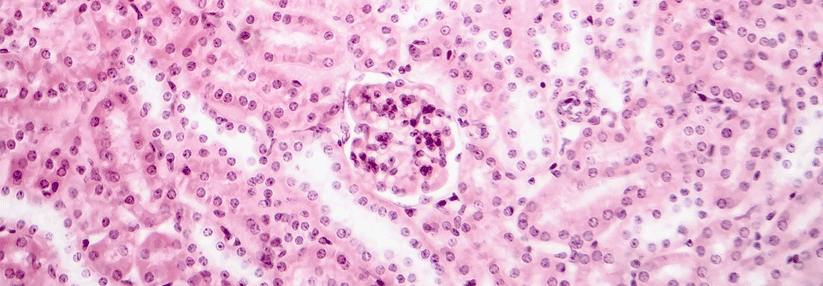
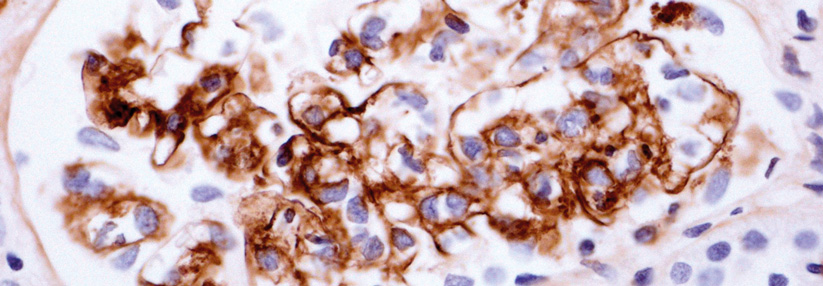
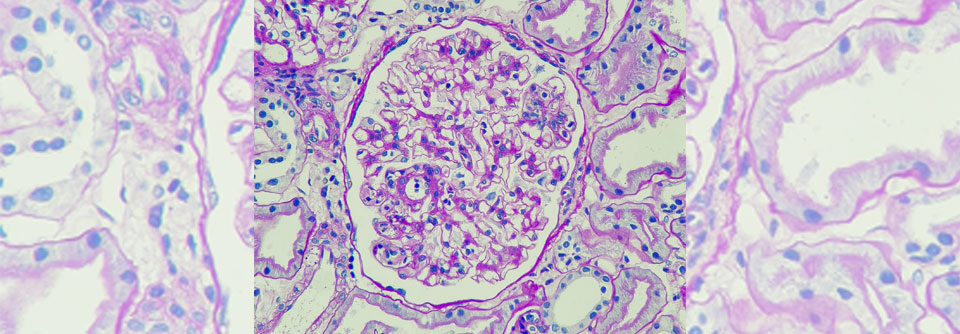
Kennzeichnend für die Immunoglobulin-A(IgA)-Nephropathie sind Ablagerungen von IgA im glomerulären Mesangium. Schreitet die Erkrankung voran, so kommt es zu entzündlichen und proliferativen Veränderungen an den Glomeruli. Im weiteren Verlauf können sich Narben bilden, was schlussendlich zu einer sekundären Schädigung der Nierentubuli im Sinne einer interstitiellen Fibrose führt. Bei jüngeren Patienten zählt die die IgA-Nephropathie zu den häufigsten Gründen für eine Nierentransplantation, schreibt Prof. Dr. Jürgen Floege von der Uniklinik der RWTH Aachen.
Ein Großteil der Patienten zeigt zunächst keine oder nur diskrete Symptome. Deshalb wird die Krankheit oft erst erkannt, wenn bereits eine manifeste Nierenfunktionsstörung vorliegt. Insbesondere bei Kindern und jungen Erwachsenen können mehrtägige Makrohämaturieepisoden, die während oder kurz nach einer viralen Infektion auftreten, auf eine IgA-Nephropathie hindeuten. Zusätzliches Indiz ist ein begleitender akuter, meist reversibler Nierenfunktionsverlust. Weiterhin gibt es Fälle mit sekundärer IgA-Nephropathie, beispielsweise im Rahmen von Darmkrankheiten (z. B. Zöliakie), Leberzirrhose und rheumatischen Erkrankungen. Vor allem bei Kindern sollte außerdem an eine IgA-Vaskulitis gedacht werden, die vermutlich eine systemische Variante der IgA-Nephritis darstellt.
Die Einschätzung der Prognose erfolgt in erster Linie anhand der geschätzten glomerulären Filtrationsrate (eGFR), dem Ausmaß der Proteinurie und des histologischen MEST-C-Score. Letzterer setzt sich zusammen aus mesangialer (M) und endokapillärer (E) Hyperzellularität, segmentaler (S) Sklerose bzw. Adhäsionen, Tubulusatrophie (T) bzw. interstitieller Fibrose und glomerulären Halbmonden („Crescents“; C).
Supportive Therapiemaßnahmen bilden wie bei vielen anderen glomerulären Erkrankungen das Fundament der Behandlung von Patienten mit IgA-Nephropathie. Hierzu gehören Lebensstilmodifikationen wie regelmäßiger Ausdauersport, Nikotinabstinenz und das Erreichen bzw. Halten eines normalen Körpergewichts.
Darüber hinaus wird gegebenenfalls eine antihypertensive Therapie mit einem Zielwert des systolischen Blutdrucks zwischen 120 und 130 mmHg im Sitzen empfohlen. Eine weitere wichtige Behandlungssäule bildet die antiproteinurische Therapie. Basis hierfür bildet eine optimierte Blockade des Renin-Angiotensin-Systems (RAS). Im Falle eines erhöhten Progressionsrisikos und einer eGFR von über 25 ml/min ist die Hinzunahme eines SGLT-2-Inhibitors sinnvoll. Vielversprechend sind auch die Blockade des Endothelin-A-Systems sowie deren Kombination mit einer RAS-Blockade. Beide Therapieansätze werden derzeit bei IgGA-Nephropathie klinisch geprüft.
Patienten mit persistierender Proteinurie oder progredienter Verschlechterung der Nierenfunktion trotz optimaler supportiver Therapie können von einer zusätzlichen systemischen Therapie mit hoch dosierten Kortikosteroiden profitieren. Dabei sollten jedoch Nutzen und Risiken sorgfältig abgewogen werden. Vor allem bei europäischen Patienten ist die Wirksamkeit einer systemischen, hoch dosierten Kortikosteroidtherapie bei IgA-Nephropathie nicht durch Studiendaten gesichert. Hinzu kommt das Risiko von Nebenwirkungen. So wurde in einer deutschen Studie eine deutliche Zunahme von Infektionen, Körpergewicht und Diabeteshäufigkeit beobachtet. Entsprechend empfiehlt Prof. Floege, beispielsweise bei Patienten mit IgA-Nephropathie und Adipositas oder nicht optimal eingestelltem Blutdruck von einer Therapie mit systemischen, hoch dosierten Kortikosteroiden abzusehen.
In sehr seltenen Fällen nimmt die IgA-Nephropathie einen rapid-progressiven Verlauf mit raschem GFR-Verlust und ausgedehnten Nekrosen im Biopsat. Bei davon betroffenen Patienten wird eine Kombinationstherapie aus Kortikosteroiden und Cyclophosphamid empfohlen. Allerdings liegt auch hier keine zufriedenstellende Evidenz für eine langfristige Wirksamkeit vor.
Mit Nefocon (verkapseltes Budesonid) steht eine spezifische Therapieoption für Hochrisikopatienten mit primärer IgA-Nephropathie zur Verfügung. Bislang darf es laut Zulassung nur bei Patienten mit einer Proteinurie über 1,5 g/g Kreatinin eingesetzt werden. Dies könnte sich jedoch aufgrund der jüngsten Studiendaten künftig ändern, so die Einschätzung von Prof. Floege.
In einer insgesamt zweijährigen Phase-3-Studie konnte durch die Gabe von Nefocon über neun Monate einer Halbierung des jährlichen GFR-Verlusts erzielt werden – unabhängig von dem Proteinurie-Wert zu Studienbeginn. Nebenwirkungen umfassten vorwiegend Ödeme, Akne und Gesichtsschwellungen. Eine Zunahme von Körpergewicht, Infektionen oder Frakturen wurde nicht berichtet.
Abschließend rät Prof. Floege dazu, Patienten mit IgA-Nephropathie, wann immer möglich, in laufende Studien einzuschließen. Beispiele für aktuelle Phase-3-Studien in Deutschland sind PROTECT (Sparsentan vs. Angiotensinrezeptorblocker), ARTEMIS (Narsoplimab), ALIGN (Atrasentan) und APPLAUSE-IgAN (Iptacopan).
Quelle: Floege J. Urologie 2024; 63: 103-111; DOI: 10.1007/s00120-023-02268