Diabetes: Nah dran am künstlichen Pankreas
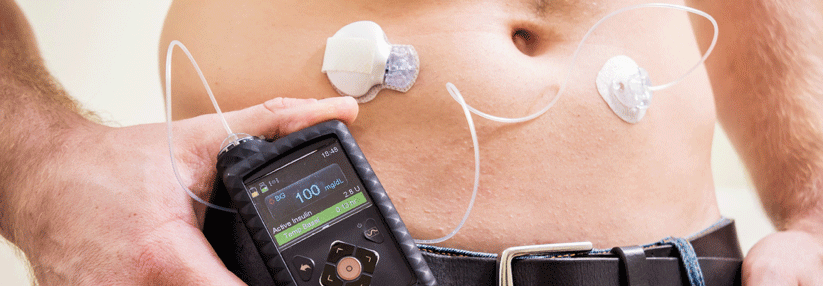
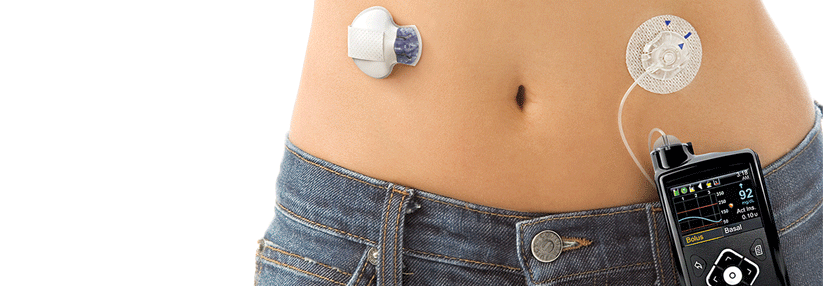 Die Komponenten bilden eine „geschlossene Schleife“ (Closed Loop): Der Glukose-Sensor (links im Bild) übermittelt die aktuelle Konzentration kabellos an eine Software. Diese berechnet die nötige Insulindosis und steuert die entsprechende Pumpe, die das Hormon über einen Katheter abgibt (rechts). Bei Mahlzeiten muss der Patient allerdings nach wie vor selbst aktiv werden.
© Medtronic
Die Komponenten bilden eine „geschlossene Schleife“ (Closed Loop): Der Glukose-Sensor (links im Bild) übermittelt die aktuelle Konzentration kabellos an eine Software. Diese berechnet die nötige Insulindosis und steuert die entsprechende Pumpe, die das Hormon über einen Katheter abgibt (rechts). Bei Mahlzeiten muss der Patient allerdings nach wie vor selbst aktiv werden.
© Medtronic
Geräte zum permanenten Glukosemonitoring sowie eine Insulinpumpentherapie erleichtern bereits die Behandlung des Typ-1-Diabetes. Beide Systeme lassen sich über mathematische Kontrollalgorithmen koppeln, sodass ein geschlossener Regelkreis entsteht – eine sogenannte „Closed Loop“, die auch als „künstliches Pankreas“ bezeichnet wird. Dadurch soll eine stabilere Blutzuckereinstellung gelingen, schreiben Dr. Dr. Lia Bally von der Universitätsklinik für Diabetologie, Endokrinologie, Ernährungsmedizin und Metabolismus in Bern und Kollegen. Bis dieser Regelkreis vollständig autonom arbeitet, müssen aber noch einige Hürden genommen werden.
Viele Geräte müssen täglich kalibriert werden
Verfügbare Glukose-Sensor-Systeme messen die Blutzuckerkonzentration im subkutanen Gewebe und übertragen diese Daten drahtlos an ein Empfängergerät, beispielsweise ein Smartphone. Alle paar Sekunden bestimmt der Sensor die Glukose und übermittelt etwa alle fünf Minuten einen Durchschnittswert. Da die interstitielle und die Blutglukosekonzentration nicht übereinstimmen, müssen die meisten Geräte täglich via kapillärer Messung durch den Anwender kalibriert werden. Insbesondere bei schnell steigenden oder sinkenden Werten sind weitere kapilläre Referenzmessungen sinnvoll.
Insulinpumpen arbeiten ausschließlich mit schnell wirksamen, subkutan injizierten Insulinanaloga. Eine individuell programmierbare kontinuierliche Abgabe (Basalrate) wird durch eine Bolusfunktion für Mahlzeiten und Korrekturen ergänzt. Die Kohlenhydratschätzung muss allerdings weiterhin durch den Anwender erfolgen. Patienten müssen zudem kurzfristige Änderungen der Insulinsensitivität berücksichtigen, beispielsweise nach körperlicher Aktivität.
Ein ersten Schritt in Richtung „Closed Loop“ wurde mit den seit einigen Jahren erhältlichen sensorunterstützten Insulinpumpen gemacht. Bei Unterschreiten eines definierten Blutzuckerwerts stoppen diese die Insulinzufuhr. Auch Modelle mit vorausschauender Hypoglykämieabschaltung sind verfügbar.
Zusätzliche Glukagonpumpe erschwert die Handhabung
Das Ziel eines „künstlichen Pankreas“ ist nun eine automatisch an den Blutzuckerspiegel angepasste und damit bedarfsgerechte Insulinzufuhr – vergleichbar mit einer gesunden Beta-Zelle. Einige Modelle geben neben Insulin über eine zweite Pumpeinheit Glukagon ab, das einer Unterzuckerung entgegenwirkt. Problematisch ist allerdings die geringe Lösungsstabilität dieses Hormons, was häufige Wechsel des Reservoirs und Pumpsystems erforderlich macht.
Allgemein unterscheidet man vollständig autonome Closed-Loop-Modelle und Hybrid-Systeme. Letztere setzen ein Mitwirken des Patienten wie beispielsweise das Ankündigen von Mahlzeiten voraus. Da die Insulinwirkung nach Abgabe etwas verzögert einsetzt, sind Hybrid-Systeme den vollautonomen in der postprandialen Glukosekontrolle derzeit überlegen, schreiben die Autoren. Im Jahr 2016 gab die US-Zulassungsbehörde FDA (Food and Drug Administration) grünes Licht für ein Hybrid-System zur Behandlung des Typ 1-Diabetes. Das Gerät wird in absehbarer Zeit auch in europäischen Ländern auf den Markt kommen.
Auch was für den anderen Typ
Moderne Technologie kann Langzeitprognose verbessern
Automatisierte Insulinabgabesysteme, so das Fazit der Kollegen, stellen einen Meilenstein der modernen Diabetestherapie dar. Die Technologie hat das Potenzial, die Langzeitprognose erheblich zu verbessern. Hürden, die es im Zusammenhang mit den Closed-Loop-Systemen zukünftig zu nehmen gilt, sind beispielsweise die Entwicklung ultraschnell wirksamer Insulinanaloga bzw. Resorptionsbeschleuniger sowie die Herstellung stabiler Glukagonformulierungen. An Single-Port-Systemen, die den Glukosesensor und die Insulinpumpe in einer Apparatur vereinen, wird bereits gearbeitet.Quelle: Bally L et al. Swiss Medical Forum 2018; 18: 82–88
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).
 Die Komponenten bilden eine „geschlossene Schleife“ (Closed Loop): Der Glukose-Sensor (links im Bild) übermittelt die aktuelle Konzentration kabellos an eine Software. Diese berechnet die nötige Insulindosis und steuert die entsprechende Pumpe, die das Hormon über einen Katheter abgibt (rechts). Bei Mahlzeiten muss der Patient allerdings nach wie vor selbst aktiv werden.
© Medtronic
Die Komponenten bilden eine „geschlossene Schleife“ (Closed Loop): Der Glukose-Sensor (links im Bild) übermittelt die aktuelle Konzentration kabellos an eine Software. Diese berechnet die nötige Insulindosis und steuert die entsprechende Pumpe, die das Hormon über einen Katheter abgibt (rechts). Bei Mahlzeiten muss der Patient allerdings nach wie vor selbst aktiv werden.
© Medtronic