Mit kleinen Tricks zum Erfolg
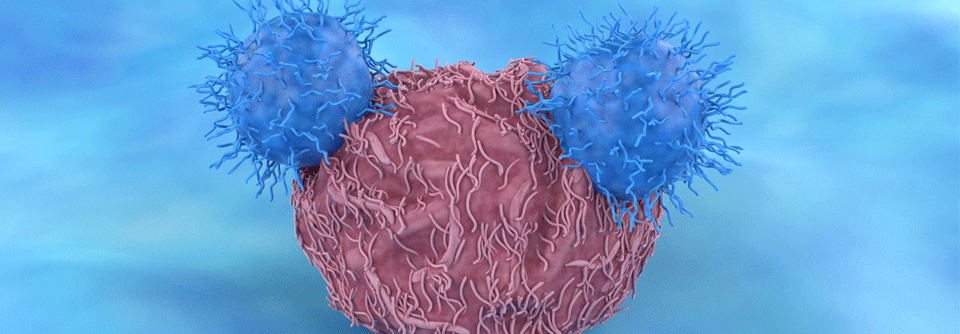 Die Forscher bestätigten die Wirksamkeit der Strategie experimentell in Xenograft-Mäusen.
© iStock/luismmolina
Die Forscher bestätigten die Wirksamkeit der Strategie experimentell in Xenograft-Mäusen.
© iStock/luismmolina
Zur Bekämpfung der AML wird eine Reihe von CAR-T-Zell-Ansätzen erprobt, wobei sich die meisten gegen CD123 richten. Das Ziel ist die Elimination nicht nur der AML-Blasten, sondern auch der leukämischen Stammzellen. Bislang gibt es aber keine leukämiespezifischen Antigene, was das Risiko für Off-Target-Toxizitäten erhöht. Die Herausforderung besteht darin, sowohl eine Wirksamkeit als auch eine gute Verträglichkeit zu garantieren.
Hohe Anti-AML-Aktivität im Tiermodell
CD123 wird ebenso wie CD33 von den meisten AML-Zellen überexprimiert, und beide finden sich auch im Rezidiv, so Dr. Sarah Tettamanti, Centro di Ricerca „M. Tettamanti“, Monza, Italien.1 Sie und ihr Team konstruierten daher CAR-T-Zellen mit Rezeptoren gegen beide Antigene; die Signalsequenzen sind so „programmiert“, dass das CAR-T-Produkt volle Aktivität gegen AML-Zellen ausübt, auf denen es beide Antigene erkennt. Normale myeloide Zellen mit nur jeweils einem der Rezeptoren hingegen werden eher verschont. Durch weitere genetische Modifikationen entstand ein Ansatz, der im Tiermodell eine hohe Anti-AML-Aktivität bei gleichzeitig sehr geringer Toxizität zeigte. Dies, so Dr. Tettamanti, ist erst ein „Proof of concept“, der das prinzipielle Funktionieren einer solchen Strategie belegt, die nun aber natürlich klinisch erprobt werden muss.
Das CD117-Antigen ist der Rezeptor für den Stammzellfaktor und wird auf hämatopoetischen Stammzellen exprimiert. Diese wiederum können sich durch Mutationen zu leukämieinduzierenden Zellen entwickeln, die für Rezidive verantwortlich sind. Gegen CD117 gerichtete CAR-T-Produkte eignen sich deshalb womöglich, um eine AML zu eliminieren. Weil die Therapie aber auch normale hämatopoetische Vorläufer zerstört, müssen diese durch ein allogenes Stammzelltransplantat ersetzt werden. Um das Transplantat nicht zu gefährden, muss sich die Aktivität der Anti-CD117-Zellen aber gezielt abschalten lassen, so Dr. Chiara Magnani, Universitätsspital Zürich.2 Dazu stellten sie und ihre Kollegen CAR-T-Zellen her, die zusätzlich zu dem gegen CD117 gerichteten Antigenrezeptor einen induzierbaren Caspase-9-Sicherheitsschalter enthielten. Dieser kann durch eine niedermolekulare „Inducer“-Substanz angeregt werden, in den CAR-T-Zellen schnell die Apoptose einzuleiten.
Die Forscher bestätigten die Wirksamkeit der Strategie experimentell in Xenograft-Mäusen. In die Tiere transplantierte menschliche hämatopoetische Stammzellen ließen sich mit dem CAR-T-Produkt ebenfalls eliminieren und dessen Aktivität konnte durch die Gabe des Caspase-Inducers beendet werden. Die Strategie könnte also vor einer hämatopoetischen Stammzelltransplantation eingesetzt werden bei Patienten mit refraktärer AML oder myelodysplastischen Syndromen, so die Referentin.
Plasma-Halbwertzeit der Adaptoren nach Belieben einstellen
Dr. Laura Volta, Universitätsspital Zürich, berichtete über einen Ansatz zur Herstellung universell anwendbarer (Uni)CAR-T-Zellen3: Dazu schaltet man zwischen der CAR-T-Zelle und dem Antigen auf Proteinebene einen Adaptor ein. Dieser enthält einen austauschbaren „Tag“, der den CAR erkennt, sowie ein weiteres Element, das an ein beliebig wählbares Tumor-Antigen bindet. Der Adaptor lässt sich nicht nur spezifisch auf bestimmte Tumor-Antigene zuschneiden: Indem die Injektion gestoppt wird, kann man die CAR-T-Zellen abschalten und so eine Myeloablation verhindern. Die Plasma-Halbwertzeit der Adaptoren kann überdies durch ihre Konstruktion – komplette oder partielle Immunglobulin-Moleküle – nach Belieben eingestellt werden. UniCAR-T-Zellen gegen drei verschiedene Antigene (CD33, CD117, CD371) konnten in vitro mit hoher Effektivität AML-Zellen lysieren.
Die Wissenschaftler testeten zudem einen kombinatorischen Ansatz, in dem Adaptoren gegen drei verschiedene AML-assoziierte Antigene gleichzeitig gegeben wurden – in der Hoffnung, dadurch AML-Zellen, die alle drei Antigene exprimieren, effektiver abzutöten als normale myeloide Zellen, die nur eines davon tragen. Die Forscher konnten die höhere Effektivität bislang in primären AML-Zellen von Patienten bestätigen, so Dr. Volta.
Quellen:
1. Tettamanti S. 4th European CAR T-cell Meeting; BA03-3
2. Magnani CF. 4th European CAR T-cell Meeting; BA03-5
3. Volta L. 4th European CAR T-cell Meeting; BA03-7
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).