Wo geht es hin beim Lungenkrebs?
 Neue, zielgerichtete Medikamente der Zukunft könnten u.a. Antikörper-Wirkstoff-Konjugate sein.
© iStock/teguhjatipras
Neue, zielgerichtete Medikamente der Zukunft könnten u.a. Antikörper-Wirkstoff-Konjugate sein.
© iStock/teguhjatipras
Aus heutiger Sicht betrachten wir den Lungenkrebs vor allem unterteilt in Subgruppen, je nachdem welche behandelbaren Mutationen vorliegen, bemerkte Prof. Dr. Dr. Pasi Jänne vom Dana-Farber Cancer Institute und der Harvard Medical School in Boston. Derzeit gebe es für neun genetische Alterationen je mindestens ein zugelassenes zielgerichtetes Medikament. Und es sei davon auszugehen, dass sich dieses Spektrum in den kommenden Jahren erweitern wird, so der Referent.
Insgesamt nannte der Experte für den Zeitraum bis 2030 fünf Bereiche, in denen er Verbesserungspotenzial bei der Lungenkrebstherapie sieht:
- einen besseren Zugang zu tumor- oder blutbasierter Genotypisierung
- einen größeren Umfang an zielgerichteten Therapien
- die weitere Optimierung bestehender Medikamente
- die Stratifizierung in Hoch- und Niedrigrisikoerkrankungen
- den (neo)adjuvanten Einsatz zielgerichteter Behandlungen
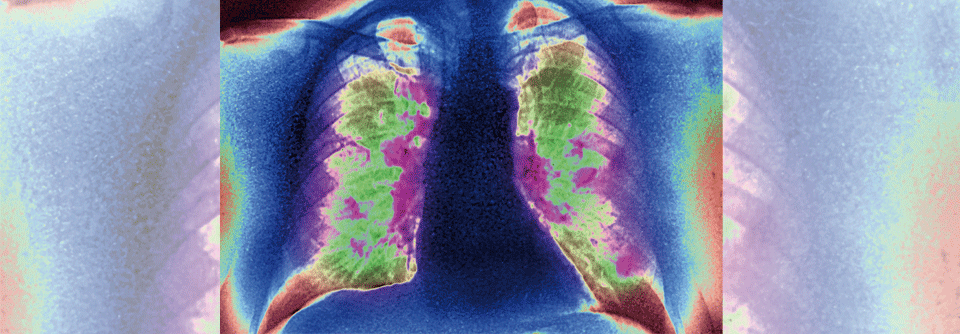
So hätten Real-World-Erhebungen aus 2019 aufgezeigt, dass zwar rund die Hälfte der NSCLC-Erkrankten im Stadium IIIB/IV auf einzelne Biomarker wie EGFR, ALK oder PD-L1 getestet wurden. Auf die Viererkombination aus EGFR, ALK, ROS und BRAF hin wurden aber bspw. nur 22 % untersucht; eine Genotypisierung, die alle sieben zu der Zeit behandelbaren Mutationen umfasste, erhielten gerade einmal 7 % der Patient:innen. „Selbst unter den Personen, bei denen solche Treibermutationen detektiert wurden, erhielt weniger als die Hälfte die entsprechende zielgerichtete Behandlung“, ergänzte Prof. Jänne. Oft verordneten Onkolog:innen stattdessen eine Immuntherapie. Auch wenn in 2021 rund 37 % der Betroffenen mittels Panel- oder NGS-Analyse untersucht wurden, bestehe sowohl beim Testen wie auch hinsichtlich dessen klinischer Umsetzung noch einiger Optimierungsbedarf. Dazu gehöre, ethnische Unterschiede beim Zugang zu dieser Diagnostik zu überwinden.
Neues Zielantigen TROP2 in der klinischen Entwicklung
Neue, zielgerichtete Medikamente der Zukunft könnten u.a. Antikörper-Wirkstoff-Konjugate sein, erklärte der Referent. Zum Beispiel auch mit anderen Wirkstoffkomponenten als Chemotherapeutika. Für gegen HER2 gerichtete Konjugate beobachteten Forschende zudem, dass sie auch im Fall einer undetektierbaren Antigenexpression oder Amplifikation wirkten. Präklinischen Ergebnissen zufolge würden mutierte HER2-Rezeptoren oft wesentlich effizienter internalisiert als der Wildtyp, sodass möglicherweise auch sehr geringe Expressionslevel für ein Ansprechen ausreichen. Eigene Arbeiten von Prof. Jänne zeigen, dass HER3-Fusionskonstrukte wiederum mehrere Resistenzmechanismen gegen EGFR-TKI umgehen könnten. Als neues Zielantigen befindet sich TROP2 in der klinischen Entwicklung.
„Zu den spannenden Erkenntnissen des vergangenen Jahres gehört, dass wir in der Lage sind, KRAS anzugreifen“, erklärte der Referent weiter. Die Verfügbarkeit von Sotorasib und Adagrasib sei für Patient:innen mit KRASG12C-Mutation von großer Bedeutung. Als Option für die andere Hälfte der nicht-G12C KRAS-Mutationen befinde sich ein pan-RAS-Inhibitor gegen die aktive Form des Proteins an der Schwelle zur klinischen Erprobung.
Die EGFR-gerichteten Therapien könnten in den nächsten 8–10 Jahren weiter verbessert werden, indem man Resistenzen überwinde und Überlebenssignalwege blockiere, beschrieb der Vortragende. In einer eigenen Phase-2-Studie untersucht er dazu die Kombination aus Osimertinib und Selumetinib, in der FLAURA2-Studie wird getestet, inwiefern eine Chemotherapie zusätzlich zu Osimertinib diesem Ziel dienen kann. „Diese Arbeiten sind sehr wichtig, denn man kann nicht einfach davon ausgehen, dass solche Kombinationen auch mit neueren EGFR-Inhibitoren Erfolg haben werden“, betonte Prof. Jänne.
Prognose durch Bereinigung von mutantem EGFR verbessert
Bei der Risikostratifizierung beginne man erst langsam zu verstehen, welche Alterationen diese definieren. Klar sei, dass eine zusätzliche TP53-Mutation zur EGFR-Alteration ein hohes Risiko berge, so der Referent. Ein zusätzlicher Verlust von RB1 steigere es noch weiter. „Im Moment behandeln wir diese Patient:innen nicht anders, das könnte sich in der Zukunft aber ändern.“ Auch habe sich gezeigt, dass die Bereinigung von mutantem EGFR aus dem Plasma die Prognose merklich beeinflusst. Zu beiden Ansätzen laufen aktuell klinische Untersuchungen.
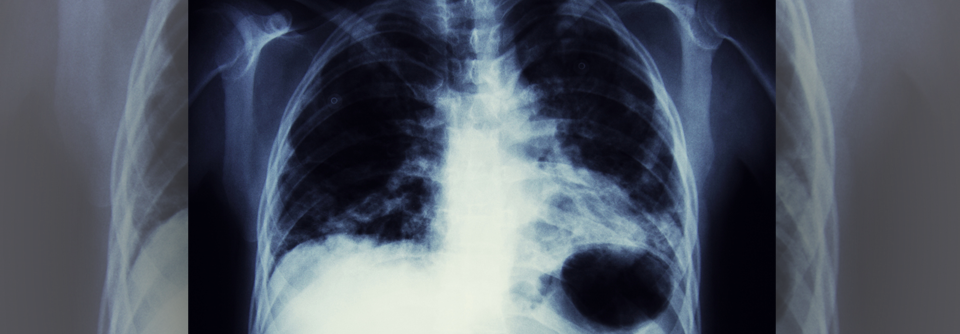
Die Situation für Betroffene in frühen Krankheitsstadien habe sich durch Osimertinib bereits gebessert, zumindest im Hinblick auf die krankheitsfreie Zeit, so Prof. Jänne. Durch (neo)adjuvante Konzepte mit zielgerichteten und Immuntherapien wird nun versucht, die Heilungsraten weiter zu verbessern. Eine FDA-Zulassung für die neoadjuvante Kombination aus Nivolumab plus Chemotherapie am 04. März 2022 infolge der Studie Checkmate 816 sei ein erster Erfolg in diesem Bereich.
Quelle: Jänne P; „Lung Cancer in 2030“; European Lung Cancer Congress 2022
European Lung Cancer Congress
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).