Aktuelle Behandlungsmöglichkeiten beim Pterygium
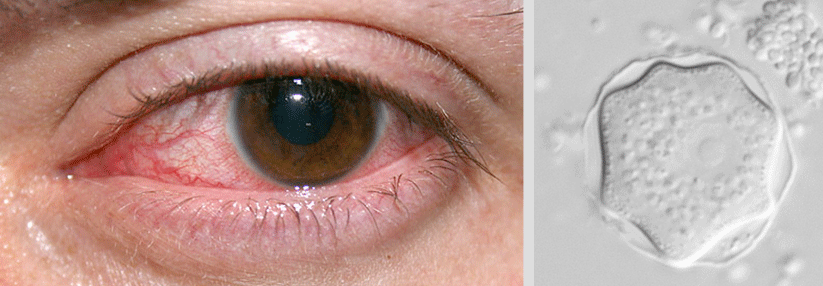
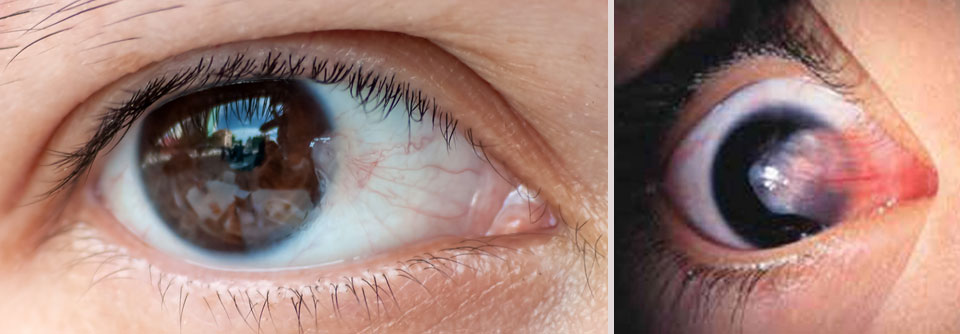 Schließt das Pterygium die optische Achse mit ein, kann das auch die Sicht stören.
© wikimedia/Wilfredor (CC BY-SA 4.0); wikimedia/Ophthalmic tutor (CC BY-SA 4.0)
Schließt das Pterygium die optische Achse mit ein, kann das auch die Sicht stören.
© wikimedia/Wilfredor (CC BY-SA 4.0); wikimedia/Ophthalmic tutor (CC BY-SA 4.0)
Das Pterygium oder „Flügelfell“ ist eine dreieckige Bindehautfalte, die sich meist nasal entwickelt, auf die Hornhautoberfläche übergreift und langsam immer weiter in Richtung Mitte wuchert. Die Beschwerden richten sich nach Sitz und Größe: Manchmal stört das Flügelfell nur kosmetisch, oft führt es zu geröteten, gereizten, trockenen Augen und unangenehmem Tränenträufeln. Im schlimmsten Fall wird auch die Sicht getrübt: So etwa, wenn das Pterygium die optische Achse mit einschließt, einen Astigmatismus hervorruft oder den Tränenfilm destabilisiert.
Barriere zwischen Hornhaut und Bindehaut aufgehoben
Die weltweite Prävalenz des Pterygiums beträgt 12 %, berichten Professor Dr. Daniel Meller von der Universitäts-Augenklinik der Friedrich-Schiller-Universität in Jena und Kollegen. Risikofaktor ist vor allem eine erhöhte UV-Exposition, daher wirken Sonnenbrillen protektiv. Begünstigen soll die Entwicklung auch das Leben in ländlichen Gegenden, Alkoholkonsum, steigendes Alter und männliches Geschlecht. Warum Rauchen in mehreren Studien mit der Entstehung negativ korreliert war, bleibt weiterhin unklar.
Bisher hat man die Entwicklung eines Flügelfells oft als degenerativen Prozess eingestuft. Dies erklärt jedoch nicht das rasche und invasive Gewebewachstum, schreiben Prof. Meller und Kollegen. Sie gehen daher von einer vernarbenden, fibrosierenden Erkrankung aus. Ursache soll ein UV-induzierter Schaden der Limbusstammzellen sein, der einen Verlust der limbalen Epithelzellbarriere zwischen Bindehaut und Hornhaut zur Folge hat: Die Hornhautoberfläche wird mehr und mehr zu Bindehaut umgebaut. Typisch sind Entzündungsreaktionen, erhöhte Zellproliferation und vermehrte Angiogenese.
Hinter dem ganzen Prozess scheint eine Fehlfunktion auf zellulärer Ebene zu stecken. Das Tumorsuppressorgen p53 ist in Pterygien oft überexprimiert, Mutationen verhindern vermutlich die normalerweise apoptotische Funktion und führen zu unkontrollierter Proliferation der fibrovaskulären Zellen. Auch ein p53-Regulator wird vermehrt produziert.
Dieser und weitere in Pterygien überexprimierte Komponenten wie Zytokine (z.B. Wachstumsfaktoren), assoziierte Proteine und angiogene Substanzen (VEGF) werden derzeit für die Entwicklung adjuvanter Therapien intensiv erforscht. So wurde u.a. geprüft, ob der VEGF-Antikörper Bevacizumab bei operierten Pterygiumpatienten die Rezidivrate senkt. Zwar wurde der subkonjunktival oder als Augentropfen applizierte Wirkstoff gut vertragen, einen Einfluss auf die Rezidivhäufigkeit hatte er jedoch nicht. Die endgültige Beurteilung dieses Therapieansatzes ist derzeit noch nicht möglich, so die Experten.
Limbusbiopsat wird zerkleinert und wieder aufgeklebt
Trotz vieler neuer Erkenntnisse bleiben Exzision und Defektdeckung bisher Therapie der Wahl. Das genaue Verfahren hängt neben der Klinik vor allem davon ab, wie groß und dick das Flügelfell ist und ob eine Entzündung vorliegt. Grundsätzlich erfordern rezidivierende Pterygien eine aggressivere Behandlung als primäre.
Die Exzision wird vom Pterygiumkopf aus ausgeführt. Meist wird nur der Hornhautanteil als Ganzes entfernt. Unter Schonung der bulbären Bindehaut exzidieren die Chirurgen dann sorgfältig das Tenongewebe, in dem nach Ansicht der Autoren das Reservoir der transformierten Fibroblasten sitzt, und dehnen die Exzision dann weiter aus (oft bis zur Karunkel oder dem orbitalen Fettgewebe).
Um die dem Pterygium zugrunde liegende Stammzelleninsuffizienz auszugleichen, verwendet man an der Jenaer Universitäts-Augenklinik zur Deckung autologe Limbus-/Bindehauttransplantate vom betroffenen Auge (temporaler oberer Limbus). Voraussetzung ist, dass das Gewebe intakt ist und eine normale Gefäßversorgung aufweist. Die so neu gebildete limbale Stammzellnische soll die Lücke „stopfen“ und für eine neue limbale Barriere sorgen, limitierender Faktor ist allerdings die Defektgröße: Man darf durch die Gewebeentnahme keine neue, iatrogene Stammzellinsuffizienz schaffen. Die Rezidivrate bei Übertragung von Limbusgewebe rangiert den Autoren zufolge zwischen 0 % und 14,29 % und ist damit niedriger als die freier Bindehauttransplantate (5,3–20 %).
Bei ausgedehnten komplexen Pterygien oder Rezidiven mit partieller Stammzellinsuffizienz nutzen Augenchirurgen in Jena die sogenannte Mini-SLET (simple limbal epithelial transplantation), eine modifizierte SLET. Bei dem Verfahren wird eine entnommene Limbusbiopsie zerkleinert und die Stückchen inklusive der darin befindlichen limbalen Stammzellen mit Fibrinkleber direkt auf die Oberfläche des erkrankten Auges aufgetragen.
Zytostatikum muss minutengenau einwirken
Die Mini-SLET braucht allerdings nur sehr wenig Ausgangsmaterial. Kombiniert mit Tenektomie und 0,02 % Mitomycin C (intraoperativ für etwa 3 min) gilt sie als sichere und effiziente Therapieoption. Verbleibt das Zytostatikum zu lange auf der Wunde, drohen allerdings verzögerte Wundheilung, Skleromalazie und Skleritis, betonen die Experten.
Von der alleinigen Amnionmembrantransplantation zur Behandlung primärer oder rezidivierender Pterygien raten die Autoren ab – die Rezidivrate ist mit bis zu 40 % zu hoch. In Kombination mit Limbustransplantaten oder einer Mini-SLET dagegen bringt sie zum Beispiel dann einen Vorteil, wenn die Defekte sehr groß sind, die Verfügbarkeit autologer Transplantate begrenzt oder die Bindehaut sehr vernarbt ist. Obsolet geworden sind nach Meinung von Prof. Meller und seinen Kollegen der primäre Verschluss und die Bare-Sklera-Technik, da nach diesen Eingriffen besonders häufig Rezidive drohen.
Quelle: Meller D et al. Z prakt Augenheilkd 2021; 42: 253-263