Beschwerden nach Herzinfarkt zügig abklären
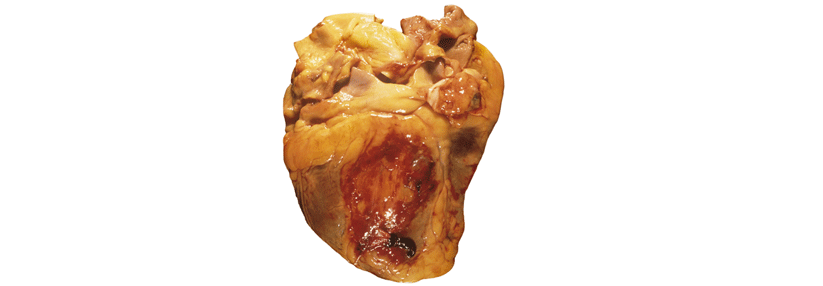 Am häufigsten rupturiert die laterale oder inferiore Ventrikelwand. Sie lässt sich aber wieder zusammennähen.
© Science Photo Library/Abelanet/Pr. R./CNRI
Am häufigsten rupturiert die laterale oder inferiore Ventrikelwand. Sie lässt sich aber wieder zusammennähen.
© Science Photo Library/Abelanet/Pr. R./CNRI
Zu den gefährlichsten Komplikationen des Myokardinfarkts zählt die Ruptur der freien Ventrikelwand, die sich üblicherweise in der ersten Woche nach dem ischämischen Akutereignis ereignet. Je nach Ausmaß reichen die Symptome von Thoraxschmerz, Unruhe, Husten und Erbrechen bis zum kardiogenen Schock und Herzstillstand. Bei der Untersuchung fallen Halsvenenstauung, leise Herztöne oder ein Pulsus paradoxus auf.
Das Septum rupturiert meist in der ersten Postinfarktwoche
Die transthorakale Echokardiographie ergibt typischerweise einen Perikarderguss mit Zeichen der Tamponade oder epikardiale Thromben im Herzbeutel. Am häufigsten rupturiert die laterale oder inferiore Wand, schreibt das Kardiologenteam um Dr. Fei Fei Gong von der Northwestern University in Chicago.
Perikardpunktion, intraaortale Ballongegenpulsation (IABP) und extrakorporale Membranoxygenierung (ECMO) können zwar für eine vorübergehende Stabilisierung sorgen. Aber die definitive Versorgung ist bisher nur operativ möglich. Falls nicht genügend gut durchblutetes Myokard für eine direkte Naht vorhanden ist, kann das Leck samt Infarktareal mit einem Patch überbrückt werden. Eine Bypassoperation in der gleichen Sitzung scheint die Prognose zu verbessern.
Als weitere brisante Komplikation droht – vornehmlich in der ersten Postinfarktwoche – eine Ruptur des Ventrikelseptums mit Links-Rechts-Shunt und entsprechender Volumenüberlastung. Die Betroffenen präsentieren sich üblicherweise mit Brustschmerz und Herzinsuffizienz bis hin zum kardiogenen Schock. Bei der Auskultation fällt ein raues pansystolisches Geräusch am linken Sternalrand auf, das im Schock auch fehlen kann. Eventuell lässt sich zusätzlich ein Schwirren tasten. Zum Nachweis der Ruptur genügt im Allgemeinen ein transthorakaler Ultraschall, basale Defekte erfordern eventuell die transösophageale Echokardiographie. Eine rein medikamentöse Behandlung ist mit einer Dreißig-Tage-Mortalität von über 90 % verbunden. Diuretika und Inotropika können aber ebenso wie IABP und ECMO helfen, die Zeit bis zur abschließenden Sanierung zu überbrücken.
Bei der Operation hat der Kardiochirurg die Wahl zwischen zwei Verfahren. Die Exzision des infarzierten Areals mit anschließender Naht kommt vor allem für kleine Defekte infrage. Größere Schäden lassen sich besser mit einem Patch versorgen, der das minderdurchblutete Gebiet samt Einriss überdeckt. Für Patienten mit hohem Operationsrisiko bietet sich als weniger invasive Option die kathetergesteuerte Applikation eines Okkluders an. In einer Analyse von 13 Studien wurde damit eine Erfolgsrate von 89 % erzielt, die Dreißig-Tage-Mortalität lag bei 32 %.
Der häufigste Grund für eine schwere akute Mitralinsuffizienz ist der Papillarmuskelabriss nach Myokardinfarkt. Die Ruptur manifestiert sich meist in der ersten Woche mit akutem Lungenödem. Das klassische Holosystolikum kann bei massiver Regurgitation und hohem atrialen Druck fehlen. Im Echokardiogramm (transthorakal, evtl. transösophageal) ist ein sich schnell bewegender, rupturierter Papillarmuskel zu erkennen, der in das linke Atrium prolabiert. Der Spektraldoppler zeigt statt des üblichen runden Musters ein v-förmiges Signal.
Vasodilatation bzw. Nachlast-Reduktion können zwar die Auswurfleistung steigern. Wegen der hohen Mortalität (> 50 %) unter rein konservativer Therapie wird jedoch zur frühzeitigen Operation geraten. In der Regel wird dabei die Mitralklappe ersetzt. Manchmal kann das abgerissene Teil auf einen benachbarten gesunden Muskel genäht werden. Als Alternative für Patienten mit schwerer Insuffizienz aufgrund einer muskulären Dysfunktion ohne Ruptur bietet sich die kathetergestützte Klappenreparatur an. In kleinen Fallserien führte dieser Eingriff zu einer Verbesserung von Hämodynamik und funktionellem Status, die bis zu einem Jahr anhielt.
Bei den pathologischen Erweiterungen der Herzkammerwand werden zwei Formen unterschieden. Echte Aneurysmen enthalten sämtliche Schichten der Herzwand und bilden sich meist in den ersten zwei Wochen nach dem Infarkt. Typische Symptome sind Angina pectoris, Herzinsuffizienz, ventrikuläre Tachykardien und linksventrikuläre Thromben. Bei der Untersuchung fällt eventuell ein diffuser Herzspitzenstoß bzw. ein dritter oder vierter Herzton auf. Auch eine persistierende ST-Hebung kann auf ein Aneurysma hinweisen.
Neben der Behandlung der Herzinsuffizienz wird zur Prävention systemischer Embolien eine orale Antikoagulation empfohlen. Bei Rupturgefahr oder arrhythmogenen Thromben sollte das Aneurysma reseziert werden. Dieser Eingriff kann mittels direkter Naht oder Patch-Ventrikuloplastie erfolgen. Hinsichtlich der Prognose besteht kein Unterschied zwischen medikamentöser und operativer Behandlung (Die Ein-Jahres-Überlebensrate beträgt 90 %).
Okklusion statt Operation möglich
Pseudoaneurysmen werden nur von Perikard und fibrösem Bindegewebe ummantelt. Sie machen sich typischerweise mit Zeichen der Herzinsuffizienz bemerkbar, können aber auch eine Angina auslösen oder asymptomatisch verlaufen. Wegen der hohen Expansions- und Rupturgefahr wird eine operative Sanierung empfohlen. Patienten mit Kontraindikationen für einen offenen Eingriff profitieren möglicherweise von einem perkutanen Verschluss mittels Okkluder.
Quelle: Gong FF et al. JAMA Cardiol 2020; DOI: 10.1001/jamacardio.2020.3690