ILD Interstitielle Lungenanomalien, aber noch keine Erkrankung
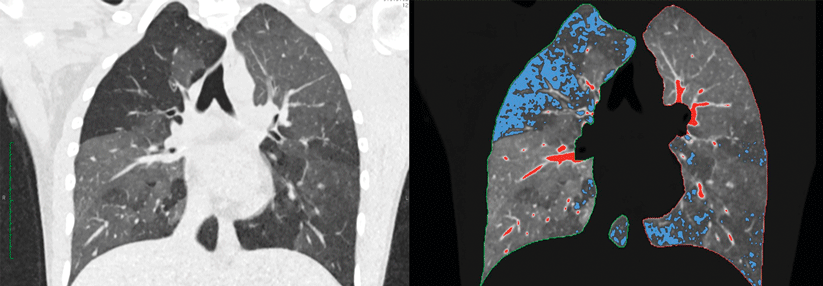
 3D-CT-Scan eines Patienten mit interstitieller Lungenerkrankung sowie interstitieller Fibrose infolge einer COPD.
© Science Photo Libray/Fung, K.H.
3D-CT-Scan eines Patienten mit interstitieller Lungenerkrankung sowie interstitieller Fibrose infolge einer COPD.
© Science Photo Libray/Fung, K.H.
Wenn bei Patienten ohne klinische Evidenz für eine interstitielle Lungenerkrankung (ILD) zufällig ILD-typische radiologische Veränderungen gefunden werden und diese mehr als 5 % des Organs betreffen, spricht man von interstitiellen Lungenanomalien (ILA). Für ILA wurde in der allgemeinen älteren Bevölkerung eine Prävalenz von etwa 7 % gefunden. Diese CT-Veränderungen haben durchaus eine Bedeutung: Aus verschiedenen Studien geht hervor, dass sie bei 20 % der Patienten in zwei Jahren und bei knapp 50 % in fünf Jahren weiter fortschreiten, schreiben Prof. Dr. Sara Tomassetti von der Universitätsklinik Florenz und Kollegen.
ILA sind assoziiert mit einem leicht beschleunigten Verlust an Lungenfunktion, der meist erheblich langsamer voranschreitet als bei Patienten mit ILD. Es gibt allerdings auch rasch progrediente ILA-Formen und langsam progrediente ILD-Formen, die sich in der Geschwindigkeit des Lungenfunktionsverlustes nicht voneinander unterscheiden. Deshalb lassen sich ILA und subklinische oder frühe ILD-Formen nicht immer gut voneinander abgrenzen.
Anomalien oft mit erhöhter Mortalität assoziiert
Auch mit einer erhöhten Sterblichkeit sind ILA assoziiert. Die AGES-Reykjavik-Studie fand eine Mortalität von 23 % für Patienten mit ILA versus 6 % für Patienten ohne. Die Todesfälle in der ILA-Gruppe waren zu 42 % kardiovaskulär, zu 25 % durch Krebs und zu 13 % respiratorisch (davon die Hälfte durch pulmonale Fibrose) bedingt.
Die Abgrenzung von ILA gegenüber normalem Lungengewebe ist für den Radiologen eine Herausforderung. Häufiger als ILA selbst finden sich unbestimmte interstitielle radiologische Veränderungen, die weniger als 5 % der Lunge betreffen. Ihre klinische Bedeutung ist unklar. Doch in großen Kohorten haben auch sie einen gewissen negativen Einfluss auf die Prognose gezeigt. Verschiedene Untersucher kommen zudem nicht selten zu verschiedenen Einschätzungen, was die Unterscheidung zwischen ILA und unbestimmten interstitiellen Veränderungen betrifft.
Eine besondere Bedeutung für die Risikoevaluation hat die Subkategorie von ILA. Es werden drei Typen unterschieden:
- nicht-subpleurale ILA
- subpleurale nicht-fibrotische ILA
- subpleurale fibrotische ILA
Die nicht-subpleurale ist die seltenste Form, die jedoch die beste Prognose hat. Sie ist gekennzeichnet durch nicht-subpleural gelegene Milchglastrübungen und neigt kaum zur Progression. Als häufigste Form der ILA gilt die subpleurale nicht-fibrotische Variante, die mit einer subpleuralen Verteilung der Veränderungen einhergeht und ein erhöhtes Progressionsrisiko aufweist. Als potenzielles Vorstadium von ILD wird vor allem die subpleurale fibrotische ILA betrachtet. Liegt die Fibrose in Form von retikulären Veränderungen und Traktionsbronchiektasen vor, ist das Progressionsrisiko versechsfacht.
Anomalien und Fibrose
Neben verschiedenen radiologischen Merkmalen haben ILA und interstitielle pulmonale Fibrose (IPF) auch funktionelle Auswirkungen, klinische Assoziationen, pathogenetische Mechanismen, prädisponierende genetische Faktoren und Risikofaktoren gemeinsam. Zu Letzteren gehören
- Rauchen
- männliches Geschlecht
- höheres Lebensalter
- Luftverschmutzung
Klinische Gemeinsamkeiten von ILA und IPF sind chronischer Husten, Belastungsdyspnoe, restriktive Einschränkungen und eine verminderte Belastungstoleranz. Zudem bestehen Assoziationen mit Lungenkrebs, COPD, schlafbezogenen Atemstörungen und Pneumonie sowohl bei ILA als auch bei IPF.
Für das Management von Patienten mit ILA gibt es bisher kaum Evidenz, sondern nur Positionspapiere und Konsensusdokumente von Experten. ILA-Patienten mit einem erhöhten Risiko für eine Progression zur ILD sollten einem Monitoring unterzogen werden, um den optimalen Zeitpunkt für den Beginn einer antifibrotischen Therapie nicht zu verpassen.
Das Positionspapier der Fleischner Society schlägt vor, das Follow-up-Prozedere am Vorhandensein von Progressionsrisikofaktoren auszurichten. Dazu gehören klinische Faktoren wie das Rauchen, therapiebedingte Faktoren wie Chemotherapie oder Bestrahlung und radiologische Faktoren wie fibrotische und/oder subpleurale ILA.
Follow-up von Symptomen abhängig machen
Ein Follow-up wird als nicht nötig erachtet bei Patienten ohne Risikofaktoren. Sie sollten aber beim Auftauchen klinischer Beschwerden den Arzt aufsuchen. Bei den übrigen sind alle 3–12 Monate eine Lungenfunktionsprüfung und alle 12–24 Monate eine HRCT durchzuführen.
Diskutiert wird noch, welche Rolle semiinvasive oder invasive Verfahren wie die bronchoalveoläre Lavage (BAL) sowie Biopsieverfahren im Follow-up haben sollen. Bei Patienten ohne Fibrose und subpleurale Veränderungen, die eine gute Prognose haben, dürften diese Untersuchungen kaum zusätzliche Informationen bringen, schreiben die Autoren. Bei Risikopatienten mit fibrotischen und/oder subpleural betonten ILA ist die Lungenbiopsie sehr sinnvoll, um den Typ einer möglichen ILD zu diagnostizieren. Und auch die BAL kann in dieser Situation zusätzliche Informationen liefern.
Quellen:
Tomassetti S et al. Eur Respir Rev 2022; 31: 210206; DOI: 10.1183/16000617.0206-2021