MRT hat bei der Früherkennung von Prostatakrebs eine bessere Trefferquote
 Das MRT mit einem Grenzscore von 4–5 hat anscheinend ein gutes Nutzen-Risiko-Profil.
© iStock/Mark Kostich
Das MRT mit einem Grenzscore von 4–5 hat anscheinend ein gutes Nutzen-Risiko-Profil.
© iStock/Mark Kostich
Ein PSA-Test kann das relative prostatakrebsassoziierte Mortalitätsrisiko um rund 20 % verringern, wenn er alle zwei bis vier Jahre durchgeführt wird. Allerdings ist die Trefferquote mit Blick auf klinisch relevante Karzinome eher suboptimal. Zudem führen auch klinisch nicht-signifikante Gewebeveränderungen zu einem positiven Ergebnis, was häufig eine unnötige Folgediagnostik nach sich zieht.
Neuere Entwicklungen wie kontrastmittelfreie, biparametrische MRT-Protokolle mit deutlich verkürzten Scanzeiten erweitern die Nutzungsmöglichkeiten der Technologie. Der Ultraschall ist eine kostengünstigere und weit verbreitete Alternative. Vor diesem Hintergrund ging eine britische Arbeitsgruppe um Dr. David Eldred-Evans vom Imperial College in London der Frage nach, ob bildgebende Verfahren sich eignen, das Prostatakrebsscreening zu verbessern.1
Rund 400 Männer nahmen an der prospektiven Studie teil
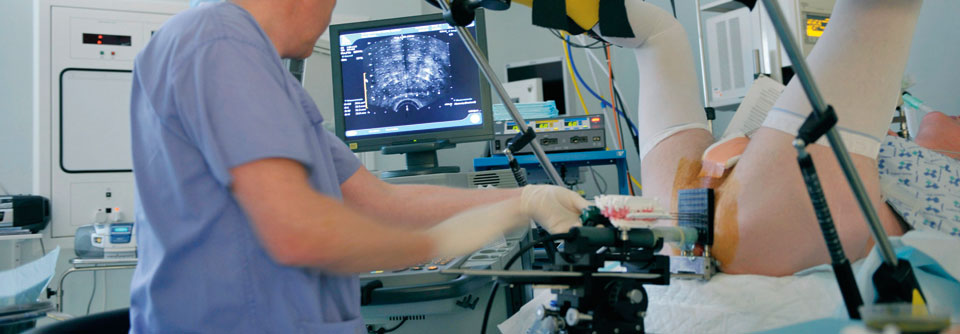
In die prospektive, verblindete, populationsbasierte Kohortenstudie IP1-PROSTAGRAM waren sieben Praxen der Primärversorgung und zwei Bildgebungszentren in Großbritannien eingebunden. 2034 Männer im Alter zwischen 50 und 69 Jahren und mit einer Lebenserwartung von mindestens zehn Jahren wurden eingeladen, von Oktober 2018 bis Mai 2019 an einem mehrgleisigen Screening auf Prostatakrebs mit PSA-Test, MRT (T2- und diffusionsgewichtet) und Ultraschall (B-Mode und Scherwellenelastographie) teilzunehmen. 408 Personen stimmten der Anwendung aller drei diagnostischen Verfahren zu. Die Ergebnisse der drei Methoden wurden unabhängig voneinander – also ohne Kenntnis der jeweils anderen Befunde – beurteilt.
Risiko der Überdiagnostik wohl nicht erhöht
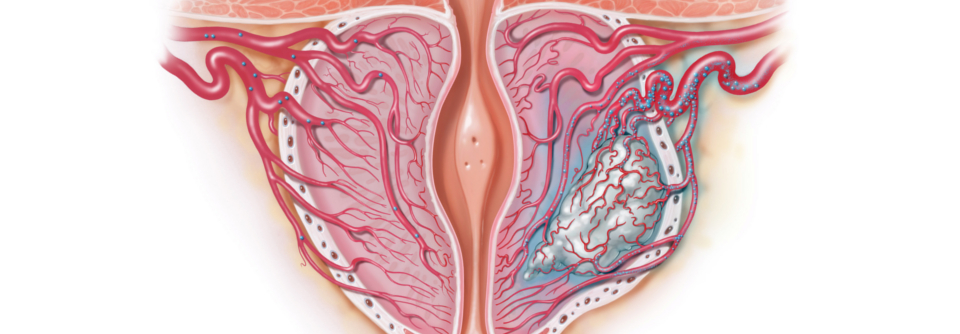
Die Auswertung zeigte eine im Vergleich zum PSA-Test erhöhte Trefferquote der kurzen, kontrastmittelfreien MRT. Für die transrektale Sonographie ließ sich dagegen kein Vorteil verifizieren.
Auswertung der Befunde
Quellen:
1. Eldred-Evans D et al. JAMA Oncol. 2021; 7: 395-402; DOI: 10.1001/jamaoncol.2020.7456
2. Lee SI, O’Shea A. A.a.O.; 7: 402-403; DOI: 10.1001/jamaoncol.2020.7294